
| A. | 硫酸生产中常采用催化剂提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电镀铜时,溶液中c(Cu2+)基本保持不变 | |
| D. | 用电解熔融氧化镁的方法制取镁 |
分析 A、SO2与O2的反应常压下转化率已经很高,高压提高了生成成本;
B、高温是为了增大反应速率,催化剂活性最大,高压是利用活性平衡移动原理,加压平衡向气体体积减小的方向进行;
C、电镀铜时,阳极上铜失电子,阴极上铜离子得电子,根据溶液中铜离子是否变化判断;
D、获取金属Mg是电解熔融氯化镁得到金属镁,依据电解原理分析产物判断.
解答 解:A、采用常压条件的原因是,常压条件二氧化硫的转化率已经很大,高压转化率增大不多,但是提高了生成成本,故A错误;
B、合成氨工业中采用高温是为了增大反应速率,催化剂活性最大,高压条件是增大压强促进平衡正向进行,提高生产效益的原理不同,故B错误;
C、电镀时,阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极铜溶解质量约等于阴极析出铜的质量,所以溶液中c(Cu2+)基本保持不变,故C正确;
D、获取金属Mg是电解熔融氯化镁得到金属镁,氧化镁的熔点太高,不宜采用电解熔融物的方法,故D错误;
故选C.
点评 本题考查了金属冶炼的方法分析,化学平衡移动原理的分析判断,电解原理应用,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
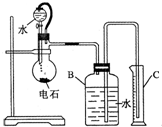 某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.
某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
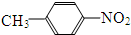 和
和 E、35Cl和37Cl
E、35Cl和37Cl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 通过调控反应条件,SO2可以100%地转化为SO3 | |
| C. | SO2的浓度与SO3的浓度相等时,反应达到平衡 | |
| D. | 因为反应放热,所以升高温度会使反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
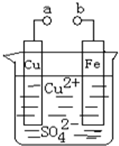
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+ | |
| C. | a和b用导线连接时电子从Cu片流向铁片 | |
| D. | a和b用导线连接时,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 4 | 2 | 0 | 0 | 放出热量:Q1 |
| 乙 | 3 | 1.5 | 1 | 0 | 放出热量:Q2 |
| 丙 | 3 | 1.5 | 1 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3=394 kJ | |
| B. | 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ•mol-1 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 达到平衡时,丙容器中SO2的体积分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
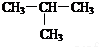

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com