
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
分析 中性溶液中可以存在①H2NCH2COOH,还可以存在H3N+-CH2COOH、③H2NCH2COO-;
强酸性溶液中甘氨酸中氨基与氢离子反应生成H3N+-CH2COoH,不可能大量存在③H2NCH2COO-;
强碱性溶液中,甘氨酸中的羧基与氢氧根离子反应生成③H2NCH2COO-,不可能大量存在②H3N+-CH2COOH,
据此进行判断.
解答 解:A.①H2NCH2COOH和②H3N+-CH2COOH在弱酸性溶液中可以大量存在,故A错误;
B.①H2NCH2COOH、③H2NCH2COO-在弱碱性溶液中可以大量存在,故B错误;
C.强酸性溶液中存在大量的②H3N+-CH2COOH,强碱性溶液中存在大量的③H2NCH2COO-,二者不可能大量存在于同一溶液中,故C正确;
D.②H3N+-CH2COOH、④H3N+-CH2COO-在弱碱性溶液中可以大量存在,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确氨基酸的组成及性质为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
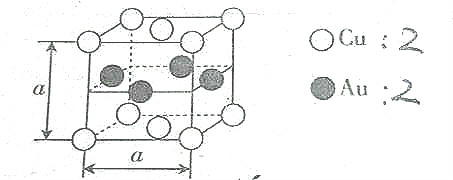
| A. | 该合金属于离子晶体 | B. | 该合金中Au的配位数是4 | ||
| C. | 该合金中Cu的配位数是8, | D. | 该合金的硬度低于Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
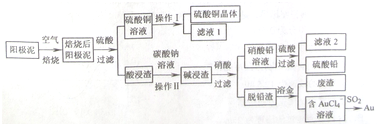
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com