
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、0.5 mol/L |
| B、1mol/L |
| C、1.5 mol/L |
| D、2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
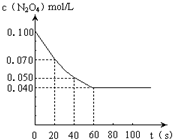 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)查看答案和解析>>
科目:高中化学 来源: 题型:
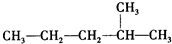 :
: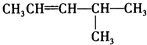 :
: :
: :
:查看答案和解析>>
科目:高中化学 来源: 题型:
 硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:
硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:| CaO或MgO |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 的正确系统命名为
的正确系统命名为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、CO2、CO均为酸性氧化物 |
| B、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、纯醋酸、四氯化碳均为电解质 |
| D、空气、混凝土、氨水均为混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com