
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 | |
| B. | 25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH溶液与0.2 mol/L H2SO4恰好中和,所得溶液的pH<7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
分析 A.100℃时,pH=10的NaOH溶液中c(OH-)=0.01mol/L,pH=2的H2SO4恰好中和,溶液为中性;
B.等体积等浓度混合后,碱过量;
C.恰好中和生成醋酸钠,水解显碱性;
D.25℃时,pH=12的氨水,碱的浓度大于0.01mol/L,pH=2的H2SO4中c(H+)=0.01mol/L,等体积混合,碱过量.
解答 解:A.100℃时,pH=10的NaOH溶液中c(OH-)=0.01mol/L,与pH=2的H2SO4溶液中氢离子浓度为0.01mol/L,恰好中和时溶液为中性,其pH=6,故A错误;
B.0.2mol•L-1Ba(OH)2溶液和0.2mol•L-1HCl等体积混合,碱过量,反应后溶液的pH>7,故B错误;
C.25℃时,0.2mol•L-1NaOH溶液与0.2mol•L-1CH3COOH恰好中和生成醋酸钠,水解显碱性,则所得溶液的pH>7,故C错误;
D.25℃时,pH=12的氨水,碱的浓度大于0.01mol/L,pH=2的H2SO4中c(H+)=0.01mol/L,等体积混合,碱过量,所得溶液的pH>7,故D正确;
故选D.
点评 本题考查酸碱混合溶液酸碱性的判断及pH的计算,题目难度中等,注意100℃时中性溶液的pH=6为解答的易错点,明确pH与浓度的关系是解答本题的关键,试题培养了学生灵活应用能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
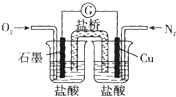
| A. | 石墨的电极反应:O2+2H20+4e-═4OH- | |
| B. | 此装置能将化学能转变为电能 | |
| C. | 电子由Cu电极经导线流向石墨电极 | |
| D. | 电池总反应:2Cu+O2+4HCl═2CuCl2+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
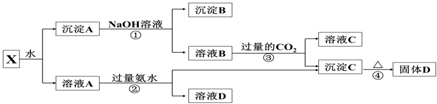
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②③④ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为NA | |
| D. | 24 g金属镁变为镁离子时失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
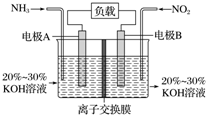 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 当有4.48 L NH3 (标准状况)反应时,转移电子为0.6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com