
分析 (1)可用BaCO3粉末与盐酸反应除杂;
(2)铁为活泼技术,可与盐酸反应而除去;
(3)可加入硫酸,反应生成二氧化碳气体.
解答 解:(1)BaCO3粉末能与盐酸反应生成氯化钡、水和二氧化碳,且BaCO3粉末不溶于水,过滤除去,能除去杂质且没有引入新的杂质,符合除杂原则,反应的离子方程式为BaCO3+2H+═Ba2++CO2↑+H2O,
故答案为:BaCO3粉末;BaCO3+2H+═Ba2++CO2↑+H2O;
(2)铁为活泼金属,可与盐酸反应而除去,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:盐酸;Fe+2H+=Fe2++H2↑;
(3)硫酸的酸性比碳酸强,可选用稀硫酸除去Na2CO3,离子方程式为:CO32-+2H+═H2O+CO2↑,故答案为:稀硫酸;CO32-+2H+═H2O+CO2↑;
点评 本题考查离子反应及物质的除杂,为高频考点,把握物质的性质及发生的离子反应为解答的关键,注意除杂时选择试剂不能引入新杂质,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | K2CO3═2K++CO32- | B. | NH4NO3═NH4++NO3- | ||
| C. | H2SO4═2H++SO42- | D. | NH4ClO3═NH4++Cl5++3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Al3+、Cl- | B. | Na+、K+、Cl-、SO42- | ||
| C. | HCO3-、Na+、Cl-、K+ | D. | I-、Fe2+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+ | B. | HA- | C. | A2- | D. | M+和HA- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Al溶于稀硝酸中:2Al+6H+═2Al3++3H2↑ | |
| B. | CuH在足量C12中燃烧:2CuH+2Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+H2 | |
| C. | 向复盐NH4Al(S04)2溶液中加入Ba(0H)2至沉淀质量最大:NH4++Al3++4OH-+2SO42-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| D. | 向饱和NaHSO3溶液中加入FeC13溶液:S032-+2Fe3++H20═S042-+2Fe2++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
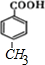 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组利用如下装置合成正丁醛.发生的反应如下:
某实验小组利用如下装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com