
【题目】下列将化学能转化为电能的是
A. 燃气灶 B. 硅太阳能电池 C. 锂电池 D. 风力发电机
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是细胞内三类生物大分子的组成及功能图示如下,请据图回答:

(1)组成细胞的元素大多以_________的形式存在。元素X、Y依次是________。
(2)若物质M可被甲基绿吡罗红染色剂染成绿色,则M的中文名称叫______________。
(3)由D加N构成的结构或生物有____________(写出两项即可)。
(4)若B是葡萄糖,那么在植物细胞中特有的E有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是 一氧化碳和氢气,是重要的化工原料。
I.已知下列反应:
①CH4(g) + H2O(g)![]() CO(g) + 3H2(g) ΔH = +206 kJ/mol
CO(g) + 3H2(g) ΔH = +206 kJ/mol
②C(s) + H2O(g) = CO(g) + H2(g) ΔH = +131 kJ/mol
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。
CH4(g)= C(s)+ 2H2(g) ΔH =______________kJ/mol。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1;c(H2O)=5.0 mol·L-1;c(CO)=1.5 mol·L-1;c(H2)=2 mol·L-1,则此时该可逆反应的状态是_____________________(填“达到平衡”、“向正反应方向移动”或“向逆反应方向移动”)。
Ⅱ.甲醇是一种可再生能源,工业上用合成气来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),分析该反应并回答下列问题:
CH3OH(g),分析该反应并回答下列问题:
(3)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,能说明该反应已达到平衡的是_____________________________。
A.体系的压强不发生变化 B.混合气的密度保持不变
C.体系中碳元素的质量分数不变 D.CO与H2的物质的量之比保持不变
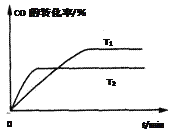
(4)如图是该反应在不同温度下CO的转化率随时间变化的曲线。T1和T2温度下的平衡常数大小关系是K1______K2 (填“>”、“<”或“=”)。理由是__________________________________________________。
(5)已知甲醇燃料电池的工作原理如图所示。该电池工作时,电池左边的电极发生的电极反应式为______________________________。
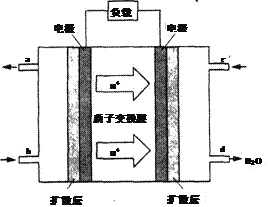
(6)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出铜电极的电极反应式_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一) A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
![]()
(1)若A、B、C、D均为化合物,而且它们的水溶液均能使湿润的蓝色石蕊试纸变红,则D的化学式为________,写出B→C的化学反应方程式:____________。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为__________________。写出A→B的化学反应方程式:_______。
(3)若A为单质,组成元素的原子所含质子的数目小于18,D为强碱,则B的化学式:________________。
(二)(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为______________ 。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是该有机物的质谱图,则其相对分子质量为________。
(2)分子式为C3H6O2的有机物,如果在核磁共振氢谱图上观察到氢的原子给出的峰有两种情况:第一种情况峰的强度比为1∶1,请写出其对应化合物的结构简式_____;第二种情况峰的强度比为3∶2∶1,请写出该化合物可能的结构简式__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式________,已知该反应在较低温条件下能自发进行,则该反应的△H ____0(填“>”“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. CO 的质量不再变化 b. 混合气体的密度不再变化
c.单位时间内生成 CO 和 NO 的物质的量相等 d. CO 和 CH3ONO 的浓度比不再变化
②10min 内该反应的速率 ν(NO)=____________;该温度下化学平衡常数 K=_________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
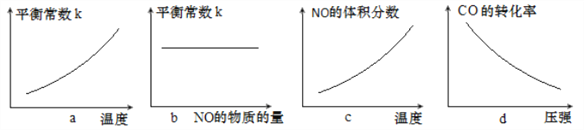
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液;②含有泥沙的食盐水;③溶有碘(I2)的酒精溶液;④乙二醇和丙三醇的混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
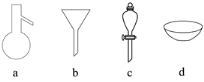
A. ①―c―分液 B. ②―b―过滤 C. ③―d―蒸发结晶 D. ④―a―蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50 mL含 Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成2.24 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算原混合溶液中Na+的物质的量浓度?___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com