


·ÖĪö £Ø1£©ŹÆ»ŅČéŹĒĒāŃõ»ÆøĘ£¬øł¾ŻĢāøÉŠÅĻ¢ŅŌ¼°ŌŖĖŲŹŲŗćŹéŠ“»Æѧ·“Ó¦·½³ĢŹ½¼“æÉ£»
£Ø2£©·“Ó¦³żÉś²śĒāŃõ»ÆĆ¾Ķā£¬»¹Éś³ÉMgCl2”¢CaCl2£¬ĮķĶā»¹æÉÄÜŹ£ÓąĒāŃõ»ÆøĘ£¬ÓÉ»Æѧ·“Ó¦ŌĄķŅŌ¼°·½³ĢŹ½ÅŠ¶ĻĪļÖŹ²ŠĮōĄ“½ā“š£»
£Ø3£©øł¾ŻĒāŃõ»ÆĆ¾µÄĮ÷³Ģ²½Öč·ÖĪö¼“æÉ£¬×čČ¼ŠĶMg£ØOH£©2¾ßÓŠ¾§Į£“ó£¬Ņ×·ÖÉ¢”¢Óėøß·Ö×Ó²ÄĮĻĻąČŻŠŌŗƵČĢŲµć£»
£Ø4£©Mg£ØOH£©2ŗĶAl£ØOH£©3ŹÜČČ·Ö½āŹ±ĪüŹÕ“óĮæµÄČČ£¬øł¾ŻMg£ØOH£©2ŗĶAl£ØOH£©3ŹÜČČ·Ö½āµÄ·“Ó¦ČČ¼°ĘäŃõ»ÆĪļµÄČŪµć·ÖĪö£»øł¾ŻµČÖŹĮæµÄĒāŃõ»ÆĪļ·Ö½āŹ±ĪüŹÕµÄČČĮæĻą¶Ō“óŠ”·ÖĪö£»
£Ø5£©ĢįČ”Ć¾µÄĮ÷³ĢÖŠ£¬ĻČ¼ÓČėŹģŹÆ»Ņ£¬ŹģŹÆ»ŅÓė¾«ÖĘĀ±Ė®ÖŠµÄĀČ»ÆĆ¾·“Ó¦ŹŌ»³öĒāŃõ»ÆĆ¾°×É«³Įµķ£¬¹żĀĖŗóŌŁ¼ÓČėŃĪĖį£¬ĒāŃõ»ÆĆ¾ÓėŃĪĖį·“Ӧɜ³ÉĀČ»ÆĆ¾ŗĶĖ®£¬Õō·¢µĆµ½ĀČ»ÆĆ¾£¬ĀČ»ÆĆ¾ŌŚĶصēµÄĢõ¼žĻĀÉś³ÉĆ¾ŗĶĀČĘų£®
½ā“š ½ā£ŗ£Ø1£©ŹÆ»ŅČéŹĒĒāŃõ»ÆøĘ£¬MgCl2ÓėŹŹĮæŹÆ»ŅČé·“Ó¦ŗĻ³É¼īŹ½ĀČ»ÆĆ¾[Mg£ØOH£©2-xClx•mH2O]£¬ŅĄ¾ŻŌŖĖŲŹŲŗć£¬»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗ2MgCl2+£Ø2-x£©Ca£ØOH£©2+2mH2O=2[Mg£ØOH£©2-xClx•mH2O]+£Ø2-x£©CaCl2£»
¹Ź“š°øĪŖ£ŗ2MgCl2+£Ø2-x£©Ca£ØOH£©2+2mH2O=2[Mg£ØOH£©2-xClx•mH2O]+£Ø2-x£©CaCl2£»
£Ø2£©“Ė·“Ó¦³żÉś²śĒāŃõ»ÆĆ¾Ķā£¬»¹Éś³ÉMgCl2”¢CaCl2£¬ĮķĶā»¹æÉÄÜŹ£ÓąĒāŃõ»ÆøĘ£¬ĖłŅŌĖ®Ļ“µÄÄæµÄŹĒ³żČ„ø½×ÅŌŚMg£ØOH£©2±ķĆęµÄæÉČÜŠŌĪļÖŹMgCl2”¢CaCl2”¢Ca£ØOH£©2µČ£»
¹Ź“š°øĪŖ£ŗ³żČ„ø½×ÅŌŚMg£ØOH£©2±ķĆęµÄæÉČÜŠŌĪļÖŹMgCl2”¢CaCl2”¢Ca£ØOH£©2µČ£»
£Ø3£©×čČ¼ŠĶMg£ØOH£©2¾ßÓŠ¾§Į£“ó£¬Ņ×·ÖÉ¢”¢Óėøß·Ö×Ó²ÄĮĻĻąČŻŠŌŗƵČĢŲµć£¬ÉĻŹö¹¤ŅÕĮ÷³ĢÖŠĶعżĖ®ČČ“¦ĄķŗĶ±ķĆꓦĄķæÉŅŌŹ¹ĒāŃõ»ÆĆ¾¾§Ģå¾ßÓŠ“ĖĢŲµć£»
¹Ź“š°øĪŖ£ŗĖ®ČČ“¦Ąķ”¢±ķĆꓦĄķ£»
£Ø4£©Mg£ØOH£©2ŗĶAl£ØOH£©3ŹÜČČ·Ö½āŹ±ĪüŹÕ“óĮæµÄČČ£¬Ź¹»·¾³ĪĀ¶ČĻĀ½µ£¬Ź¹»·¾³ĪČ¶Ø“ļµ½×Å»šµćŅŌĻĀ£¬×čÖ¹ĮĖČ¼ĮĻµÄČ¼ÉÕ£»ĒŅĶ¬Ź±Éś³ÉµÄÄĶøßĪĀ”¢ĪČ¶ØŠŌŗƵÄMgO”¢Al2O3ø²øĒŌŚæÉČ¼Īļ±ķĆę£¬Ź¹×čČ¼Š§¹ūøü¼Ń£¬Mg£ØOH£©2µÄĪüČČŠ§ĀŹĪŖ£ŗ$\frac{81.5KJ/mol}{58g/mol}$=1.41 kJ•g-1£»Al£ØOH£©3µÄĪüČČŠ§ĀŹĪŖ£ŗ$\frac{87.7KJ/mol}{78g/mol}$=1.12 kJ•g-1£»
µČÖŹĮæµÄMg£ØOH£©2±ČAl£ØOH£©3ĪüČȶą£¬ĖłŅŌ×čČ¼Š§¹ū½ĻŗƵďĒMg£ØOH£©2£»
¹Ź“š°øĪŖ£ŗMg£ØOH£©2ŗĶAl£ØOH£©3ŹÜČČ·Ö½āŹ±ĪüŹÕ“óĮæµÄČČ£¬Ź¹»·¾³ĪĀ¶ČĻĀ½µ£»Ķ¬Ź±Éś³ÉµÄÄĶøßĪĀ”¢ĪČ¶ØŠŌŗƵÄMgO”¢Al2O3ø²øĒŌŚæÉČ¼Īļ±ķĆę£¬×čČ¼Š§¹ūøü¼Ń£»
Mg£ØOH£©2£»Mg£ØOH£©2µÄĪüČČŠ§ĀŹĪŖ$\frac{81.5KJ/mol}{58g/mol}$=1.41 kJ•g-1£¬Al£ØOH£©3µÄĪüČČŠ§ĀŹĪŖ$\frac{87.7KJ/mol}{78g/mol}$=1.12 kJ•g-1£¬µČÖŹĮæµÄMg£ØOH£©2±ČAl£ØOH£©3ĪüČȶą£»
£Ø5£©ĢįČ”Ć¾µÄĮ÷³ĢÖŠ£¬ĻČ¼ÓČėŹģŹÆ»Ņ£¬ŹģŹÆ»ŅÓė¾«ÖĘĀ±Ė®ÖŠµÄĀČ»ÆĆ¾·“Ó¦ŹŌ»³öĒāŃõ»ÆĆ¾°×É«³Įµķ£¬¹żĀĖŗóŌŁ¼ÓČėŃĪĖį£¬ĒāŃõ»ÆĆ¾ÓėŃĪĖį·“Ӧɜ³ÉĀČ»ÆĆ¾ŗĶĖ®£¬Õō·¢µĆµ½ĀČ»ÆĆ¾£¬ĀČ»ÆĆ¾ŌŚĶصēµÄĢõ¼žĻĀÉś³ÉĆ¾ŗĶĀČĘų£¬¹Ź“ĖĮ÷³ĢČēĻĀ£ŗ £»
£»
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éµÄŹĒ¹¤ŅµÉś²śĮ÷³ĢĶ¼£¬Éę¼°ÖŖŹ¶µć½Ļ¶ą£¬ÅąŃųĮĖѧɜ·ÖĪöĪŹĢāµÄÄÜĮ¦£¬ÕĘĪÕø÷²½·“Ó¦ŌĄķŹĒ½ā¾ö“ĖĄąĢāÄæµÄ¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
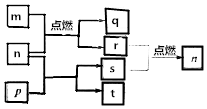 ¶ĢÖÜĘŚÖ÷×åŌŖĖŲX”¢Y”¢Z”¢WŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬mŹĒWµÄµ„ÖŹ£¬rŹĒXµÄµ„ÖŹ£¬sŹĒYµÄµ„ÖŹ£¬n”¢p¼°qŹĒÕāŠ©ŌŖĖŲ×é³ÉµÄ¶žŌŖ»ÆŗĻĪļ£»tÓÉĘäÖŠµÄČżÖÖŌŖĖŲ×é³É£¬ĘäĖ®ČÜŅŗ³Ź¼īŠŌ£»pŹĒµ»ĘÉ«¹ĢĢ壬qŹĒŅ»ÖÖÄĶøßĪĀ²ÄĮĻ£¬ĖüĆĒµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
¶ĢÖÜĘŚÖ÷×åŌŖĖŲX”¢Y”¢Z”¢WŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬mŹĒWµÄµ„ÖŹ£¬rŹĒXµÄµ„ÖŹ£¬sŹĒYµÄµ„ÖŹ£¬n”¢p¼°qŹĒÕāŠ©ŌŖĖŲ×é³ÉµÄ¶žŌŖ»ÆŗĻĪļ£»tÓÉĘäÖŠµÄČżÖÖŌŖĖŲ×é³É£¬ĘäĖ®ČÜŅŗ³Ź¼īŠŌ£»pŹĒµ»ĘÉ«¹ĢĢ壬qŹĒŅ»ÖÖÄĶøßĪĀ²ÄĮĻ£¬ĖüĆĒµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | Y”¢Z”¢WµÄ¼ņµ„Ąė×ӵĵē×Ó²ć½į¹¹ĻąĶ¬ | |
| B£® | Ō×Ó°ė¾¶£ŗr£ØX£©£¼r£ØY£©£¼r£ØZ£©£¼r£ØW£© | |
| C£® | ¼ņµ„Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗX£¾Y | |
| D£® | YÓėZĮ½ÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļŅ»¶ØÖ»ŗ¬Ąė×Ó¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÖŠ×ÓŹżĪŖ20µÄĀČŌ×Ó£ŗ${\;}_{17}^{37}$Cl | |
| B£® | “ĪĀČĖįµÄµē×ÓŹ½£ŗ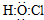 | |
| C£® | µŖŌ×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ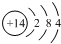 | |
| D£® | Ģ¼ĖįĒāÄʵĵēĄė·½³ĢŹ½£ŗNaHCO3=Na++H++CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
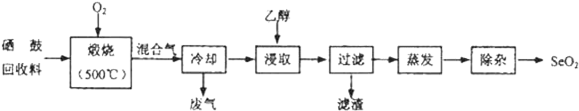
| ĪļÖŹ | ČŪµć | ·Šµć | Čܽā¶Č |
| SeO2 | 340”ę£Ø315”ęÉż»Ŗ£© | 684”ę | Ņ×ČÜÓŚĖ®ŗĶŅŅ“¼ |
| TeO2 | 733”ę£Ø450”ęÉż»Ŗ£© | 1260”ę | Ī¢ČÜÓŚĖ®£¬²»ČÜÓŚŅŅ“¼ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
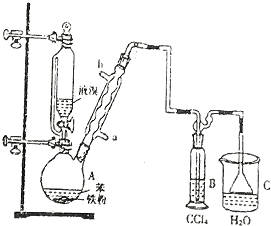
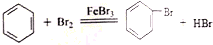 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
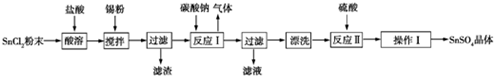
²éæ““š°øŗĶ½āĪö>>
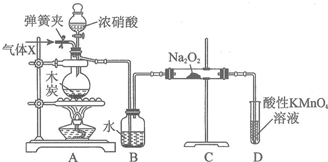
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com