
| A. | 标准状况下,11.2L的CH2Cl2中所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 8.7MnO2与40mL10mL/L的浓盐酸充分反应,生成的氯气分子数小于0.1NA | |
| D. | 1molCaC2中所含阴离子数为2NA |
分析 A、标况下二氯甲烷为液态;
B、求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来分析;
C、二氧化锰只能和浓盐酸反应,和稀盐酸不反应;
D、CaC2中含1个钙离子和1个C22-.
解答 解:A、标况下二氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、28g乙烯的物质的量为1mol,而1mol乙烯中含6mol共用电子对,故含6NA个,故B错误;
C、二氧化锰只能和浓盐酸反应,和稀盐酸不反应,故浓盐酸不能反应完全,则生成的氯气分子小于0.1NA个,故C正确;
D、CaC2中含1个钙离子和1个C22-,故1mol碳化钙中含阴离子为NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:推断题
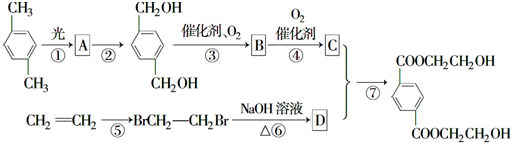
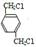 ,B
,B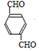 ,
,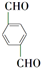 +O2$\stackrel{催化剂}{→}$
+O2$\stackrel{催化剂}{→}$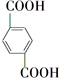
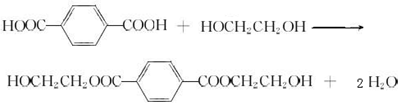
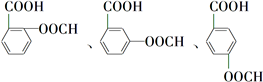 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、淀粉、蔗糖和蛋白质在一定条件能发生水解反应 | |
| B. | 甲烷和苯都不能与溴水、酸性高锰酸钾溶液发生反应,但苯不属于饱和烃 | |
| C. | 甲烷与氯气制备一氯甲烷符合绿色原子经济要求 | |
| D. | 乙烯聚合为聚乙烯高分子材料符合绿色原子经济要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
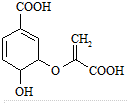
| A. | 分枝酸分子中含有2种官能团 | |
| B. | 分枝酸可与乙醇发生酯化反应 | |
| C. | 分枝酸是芳香族化合物 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+,K+,NO3-,I- | B. | AlO2-,Na+,CO32-,K+ | ||
| C. | Ba2+,Fe3+,Cl-,S2- | D. | K+,SiO32-,S2-,Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
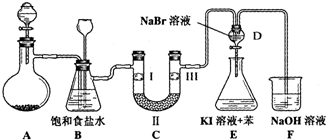
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com