
某溶液只可能含有以下离子中的若干种:H+、NH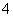 、K+、Mg2+、NO
、K+、Mg2+、NO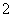 、CO
、CO 、NO
、NO ,现取两份200 mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2===H2O+NO2↑+NO↑)
,现取两份200 mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2===H2O+NO2↑+NO↑)
①第一份加足量AgNO3溶液后,有11.68 g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2 g;②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0 g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100 mL 0.5 mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。
根据上述实验,以下推测不正确的是( )
A.原溶液一定不存在较大浓度的H+、Mg2+
B.原溶液确定含NH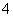 、NO
、NO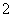 、CO
、CO ,且物质的量之比为5:2:1
,且物质的量之比为5:2:1
C.不能确定原溶液是否含有K+、NO
D.实验中产生的棕色气体遇空气颜色会加深
解析:本题考查了离子检验,意在考查考生的计算能力和判断能力。根据实验①②可推知,溶液中含有CO 、NO
、NO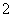 ,则一定不存在较大浓度的H+、Mg2+,A选项正确;根据实验③可知含有NH
,则一定不存在较大浓度的H+、Mg2+,A选项正确;根据实验③可知含有NH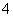 ,由H2SO4+2NH3===(NH4)2SO4得,n(NH
,由H2SO4+2NH3===(NH4)2SO4得,n(NH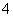 )=2n(SO
)=2n(SO )=2×0.1 L×0.5 mol·L-1=0.1 mol;11.68 g沉淀为Ag2CO3和AgNO2的混合物,n(CO
)=2×0.1 L×0.5 mol·L-1=0.1 mol;11.68 g沉淀为Ag2CO3和AgNO2的混合物,n(CO )=n(CaCO3)=2.0 g÷100 g·mol-1=0.02 mol,则m(Ag2CO3)=0.02 mol×276 g·mol-1=5.52 g,m(AgNO2)=11.68 g-5.52 g=6.16 g,n(NO
)=n(CaCO3)=2.0 g÷100 g·mol-1=0.02 mol,则m(Ag2CO3)=0.02 mol×276 g·mol-1=5.52 g,m(AgNO2)=11.68 g-5.52 g=6.16 g,n(NO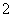 )=n(AgNO2)=6.16 g÷154 g·mol-1=0.04 mol,所以原溶液确定含NH
)=n(AgNO2)=6.16 g÷154 g·mol-1=0.04 mol,所以原溶液确定含NH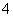 、NO
、NO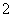 、CO
、CO ,且物质的量之比为5:2:1,B选项正确;根据电荷守恒可知,溶液中一定有NO
,且物质的量之比为5:2:1,B选项正确;根据电荷守恒可知,溶液中一定有NO ,不能确定是否含有K+,C选项错误;产生的棕色气体为NO、NO2和CO2的混合物,NO遇空气会生成NO2,颜色会加深,D选项正确。
,不能确定是否含有K+,C选项错误;产生的棕色气体为NO、NO2和CO2的混合物,NO遇空气会生成NO2,颜色会加深,D选项正确。
答案:C


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
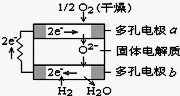
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是
A.有O2放电的a极为电池的负极
B.a极对应的电极反应为:O2+ 2H2O+ 4e--= 4OH-
C.有H2放电的一极电极反应为:H2+O2- -2 e- =H2O
D.该电池的总反应方程式为:2H2+ O2= 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
A.加入适量的氢氧化钠固体 B.将溶液稀释到原体积的 10倍
C.加入等体积0.2 mol·L-1氨水 D.降低溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
向某无色溶液中分别进行下列操作,所得现象和结论正确的是( )
A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+
B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl-
C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO
D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH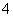
查看答案和解析>>
科目:高中化学 来源: 题型:
某矿样用过量酸溶解并过滤,所得滤液A主要含CO 、Ni2+、SO
、Ni2+、SO 、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:
、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:

可能用到的有关数据如下:
| 物质 | 开始沉淀的pH | 沉淀完全的pH | Ksp(25 ℃) |
| Fe(OH)3 | 2.7 | 3.7 | 4.0×10-38 |
| Fe(OH)2 | 7.6 | 9.6 | 8.0×10-16 |
| Ni(OH)2 | 7.2 | 9.2 | 5.5×10-16 |
| Mg(OH)2 | 9.6 | 11.1 | 1.2×10-11 |
请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11 mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1 KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )
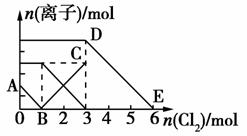
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中n(FeBr2)=3 mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
将含O2和CH4的混合气体充入装有23.4gNa2O2的密闭容器中,点火花点燃,反应结束后,容器温度为150℃、压强为0 Pa。将残留物溶于水,无气体逸出。下列叙述正确的是( )
A.原混合气体中O2和CH4的体积比为2∶1;
B.原混合气体中O2和CH4的体积比为1∶2;
C.残留固体中有Na2CO3和NaOH;
D.残留固体中只有Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)  N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的 判断正确的是
判断正确的是
| A | B | C | D |
|
|
|
|
|
| 升高温度,平衡常数减小 | 0~3s内,反应速率为: v(NO | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com