
【题目】太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜为阳离子交换膜,电池反应式为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )

A.放电时Li+从左边移向右边,PO43-从右边移向左边
B.放电时,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4
C.充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D.紧急情况时,电解质可以用Li2SO4饱和溶液代替
【答案】B
【解析】
M电极材料是金属锂和碳的复合材料,所以该电池放电时M电极发生LixC6-xe-=6C+xLi+,所以M为负极,N为正极;则充电时M为阴极,N为阳极。
A.放电时,阳离子向正极移动,阳离子交换膜只允许阳离子通过,所以Li+从左边移向右边,PO43-不发生移动,故A错误;
B.放电时负极反应为LixC6-xe-=6C+xLi+,总反应减去负极反应即可得正极反应为:Li1-xFePO4+xLi++xe-=LiFePO4,故B正确;
C.充电时M为阴极,与电源负极相连,发生反应6C+xLi++xe-=LixC6,故C错误;
D.Li单质可以与水反应,所以不能用水溶液做电解质,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变
B.配位数为4的配合单元一定呈正四面体结构,配位数为6的配合单元一定呈正八面体结构
C.配位化合物Ni(CO)4结构如图,1mol分子中所含的配位键个数有8NA
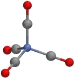
D.[Pt(NH3)6]2+和[PtCl4]2-中,其中心离子的化合价都是+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为_____________,其固体的晶体类型为_____________。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为_____________(填化学式,下同),还原性由强到弱的顺序为____________,键角由大到小的顺序为_____________。
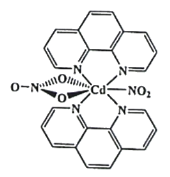
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有_________mol,该螯合物中N的杂化方式有__________种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标 原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |
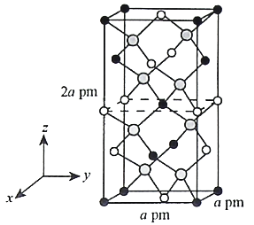
一个晶胞中有_________个Sn,找出距离Cd(0,0,0)最近的Sn_________(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某兴趣小组同学设计的原电池装置,下列叙述正确的是( )
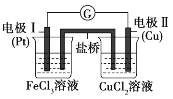
A.电极I上发生氧化反应
B.可将CuCl2溶液改为KCl溶液
C.该原电池的总反应为Fe3++Cu=Cu2++Fe2+
D.盐桥中装有含氯化钾的琼脂,K+移向CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
元素 | X | Y | Z | W |
最高价氧化物的水化物 | H3ZO4 | |||
| 1.00 | 13.00 | 1.57 | 0.70 |
A.元素电负性:Z<WB.简单离子半径:W<Y
C.元素第一电离能:Z<WD.简单氢化物的沸点:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 呈粉红色,
呈粉红色,![]() 呈蓝色,
呈蓝色,![]() 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:![]() ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
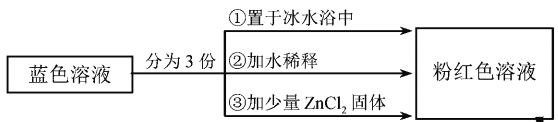
以下结论和解释正确的是
A.等物质的量的![]() 和
和![]() 中σ键数之比为3:2
中σ键数之比为3:2
B.由实验①可推知△H<0
C.实验②是由于c(H2O)增大,导致平衡逆向移动
D.由实验③可知配离子的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
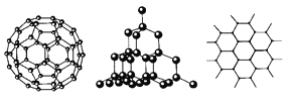
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”、“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com