
| A. | 电子排布式1s22s22p63s23p64s3违反了泡利原理 | |
| B. | 基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理 | |
| C. | 根据构造原理,原子核外电子填充顺序为1s2s2p3s3p4s3d4p5s5p4d6s4f5d6p | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X2+ |
分析 A.泡利不相容原理:每个原子轨道上最多只能容纳 2个自旋状态相反的电子;
B.根据4s轨道能量比3d轨道能量还低分析;
C.根据构造原理,原子核外电子填充顺序1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p;
D.该元素第三电离能剧增,最外层应有2个电子,表现+2价.
解答 解:A.根据泡利不相容原理知,4s轨道最多排2个电子,故A正确;
B.因为4s轨道能量比3d轨道能量还低,所以基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理,应该为1s22s22p63s23p63d34s2,故B正确;
C.根据构造原理,原子核外电子填充顺序1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p,故C错误;
D.该元素第三电离能剧增,最外层应有2个电子,表现+2价,当它与氯气反应时最可能生成的阳离子是X2+,故D正确;
故选C.
点评 本题考查核外电子排布以及电离能的定义和应用,比较基础,侧重对基础知识巩固,注意对构造原理的全面掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
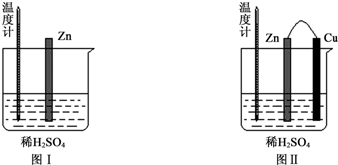
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:PH3>NH3>H2O | |
| B. | CO2分子中的化学键为非极性键 | |
| C. | NH3分子中N原子的杂化轨道类型是sp2 | |
| D. | NH4+为正四面体结构,可推测出PH4+也为正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、Z的电负性大小顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | Y、Z形成的分子的空间构型可能是正四面体 | |
| D. | 若有WY2,则WY2分子中σ键与π键的数目之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
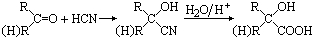 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: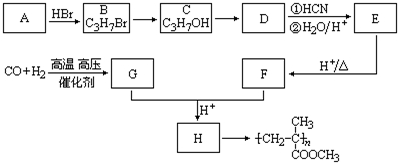
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示.已知X、Y、Z三元素的质子数之和为40,请回答:
X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示.已知X、Y、Z三元素的质子数之和为40,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不大于7 | B. | 一定不小于7 | C. | 一定等于7 | D. | 可能大于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com