
����Ŀ����ѧ������������������������أ������йصĻ�ѧ����֪ʶ���Ը������ǵ����
��I���ճ�������ʹ�õĸ��ֵ�ؾ������û�ѧ��Ӧ����ѧ��ת��Ϊ���ܣ����ָ����ĵ�صķ�չ�ǻ�ѧ�������һ���ش��ס���ش������йػ�ѧ��Դ�����⣺
��1�������йص�ص���������ȷ����___________��
A��п�̸ɵ�ع���һ��ʱ���̼����ϸ B������ȼ�ϵ�ؿɽ�����ֱ��ת��Ϊ����
C������ȼ�ϵ�ع���ʱ�����ڸ��������� D��̫���ܵ�ص���Ҫ�����Ǹߴ��ȵĶ�������
��2��пͭԭ���װ����ͼ��ʾ�����������ӽ���Ĥֻ���������Ӻ�ˮ����ͨ���������й�������ȷ������ ��
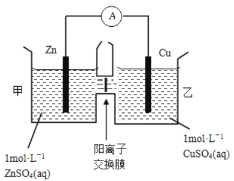
A��ͭ�缫�Ϸ���������Ӧ
B����ع���һ��ʱ��׳ص�c(SO42-)��С
C����ع���һ��ʱ����ҳ���Һ������������
D���׳��е����������ҳ��ƶ���������Һ�е��ƽ��
��II������ˮ����������ˮʱ����Ҫ�õ���ˮ������ˮ��������ɱ��������
��3���������(K2FeO4)��һ�����Ͷ��ˮ����������ҵ���ж��ַ����Ʊ�������أ�����һ�ַ�����������������Һ���ô����������������������÷�Ӧ�Ŀ������ӷ���ʽ��ʾΪ___________��
��4���ø�����غ�п�Ƴɵĸ������Ե�أ��ܴ������ͨ���Ե�ض�50%�ĵ��ܣ���֪�õ�ص��ܷ�ӦΪ2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2�����ĵ缫��Ӧ��______________��
���𰸡���1��C��
��2��CD��
��3��2Fe(OH)3+3ClO- +4OH- =2FeO42-+3Cl-+5H2O��
��4��3Zn��6e-+10OH- =Zn��+2ZnO2����-+5H2O��
��������
���������I��1��A��п�̸ɵ����̼��Ϊ���������Ե�ع���һ��ʱ���̼���������䣬����B������ȼ�ϵ�ؿɽ���ѧ��ת��Ϊ���ܣ�����C������ȼ�ϵ�ع���ʱ�����ڸ���ʧȥ���ӣ�����������ȷ��D��̫���ܵ�ص���Ҫ�����Ǹߴ��ȵĹ裬������2����Cu��Znԭ����У�������ԣ�Zn>Cu������Zn�Ǹ�����Cu��������A������ͭ�缫�Ϸ�����ԭ��Ӧ������B����ع���һ��ʱ��׳���Zn2+Ũ���������Ը���ͬ�ֵ����ų⣬���ֵ���������ԭ����Һ��SO42-�����ƶ����ʼ׳ص�c(SO42-)������C����ع���һ��ʱ����ҳ���Cu2+���Ϸŵ磬����Cu�����ڵ缫�ϸ��š����ڽ���Ĥ��������Ĥ��������Һ�е�Zn2+����뵽�ҳأ�����Zn��Cu����ת�Ƽ�Ħ��������֪��Һ�����������ӣ���ȷ��D���ҳ���Cu2+�ŵ磬�׳��еIJ��ϲ���Zn2+��Ϊʹ��Һ�ʵ����ԣ���׳ص����������ҳ��ƶ����Ӷ�������Һ�е��ƽ�⣬��ȷ����II����3���������(K2FeO4)��һ�����Ͷ��ˮ����������ҵ���ж��ַ����Ʊ�������أ�����һ�ַ�����������������Һ���ô������������������������ݵ����غ㼰����غ㡢ԭ���غ㣬�ɵø÷�Ӧ�����ӷ���ʽΪ2Fe(OH)3+3ClO- +4OH- =2FeO42-+3Cl-+5H2O����4���ø�����غ�п�Ƴɵĸ������Ե�أ��ܴ������ͨ���Ե�ض�50%�ĵ��ܣ���֪�õ�ص��ܷ�ӦΪ2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2�������ܷ�Ӧ����ʽ��֪ZnԪ�ػ��ϼ����ߣ�ʧȥ���ӣ�����������Ӧ��Zn�������������ܷ�Ӧʽ��֪�������ĵ缫��Ӧ��3Zn��6e-+10OH- =Zn��+2ZnO2����-+5H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�Ƕ�����Ԫ����ɵ���ѧ���������ʣ����ǵ�ת����ϵ��ͼ��ʾ�����ֲ���ͷ�Ӧ������ȥ����

��1����DΪ��ɫ��״���������AĦ��������ȣ���Ӧ�������ӷ���ʽΪ�� ��
��2����AΪCO����D�Ļ�ѧʽΪ ��
��3����CΪ������Ҫ���ŵ�һ�ֳ������������壬EΪһ�����ᣨ�����ᣩ����A�Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��5���л���ѧ����]����һ��߷���ҩ��P�ĺϳ�·�����£�

��֪��
��1��AΪһԪ���ᣬ8.8g A������NaHCO3��Һ��Ӧ����2.24L CO2����״������A�ķ���ʽ��
��
��2��B��E�ĺ˴Ź�������ֻ��2�ַ壬D��ϵͳ������ ��E���еĹ������� ��
��3��D�������E��Ӧ����F����D���������õ�F�䡣F��Ľṹ��ʽ�� ��
��4����Ӧ�������� ��G����P�ķ�Ӧ���� ��
��5��P��NaOHˮ��Һ�����Ļ�ѧ����ʽ�� ��
��6��д��2�ַ�������Ҫ��IJ���ҵ�ͬ�ֵ����壺�ٺ��б���������������˴Ź�������Ϊ4��壬�ҷ������Ϊ9��6��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪����Fe2O3(s) + 3C(ʯī) = 2Fe(s) + 3CO(g) ��H 1 = +489.0 kJ��mol��1
��C(ʯī) +CO2(g) = 2CO(g) ��H 2 = +172.5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ�������������������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�Ħ�H 0���>������<����������
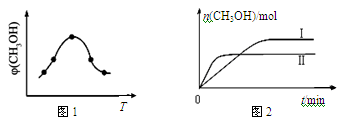
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ�����ߢ��Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)���жϵ����� ��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ�����Ӧ����ʽΪ ����ʼ����̼��=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60������NH3��ƽ��ת����Ϊ ��
��������CO2ͨ�뱥�Ͱ�ˮ�пɵõ���NH4HCO3����֪������һˮ�ϰ�Kb=1.8��10��5��̼��һ�����볣��Kb=4.3��10��7����NH4HCO3��Һ�� ������ԡ��������ԡ��������ԡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2��ѧ�뼼�������Ṥҵ�ڹ�����ռ�м�����Ҫ�ĵ�λ��
��1����ҵ������ʱ�������������Ҫ�ɷ�ΪFeS2��������Ԫ�صĻ�����Ϊ ��
��2�������������������ǻ��ʹ�ҵ������������ij��������� (��дһ��)��
��3�����������У����ݻ�ѧƽ��ԭ����ȷ�����������ʩ�� (��д���)��
A����ʯ�������¯֮ǰ�ȷ��� B��ʹ��V2O5������
C��ת������ʹ�����˵��¶� D���������¯����Ҫ�й����Ŀ���
E���������ڳ�ѹ�½��� F������������98.3%��Ũ��������SO3
��4�������Ṥҵ�У�ͨ�����з�Ӧʹ��������ת��Ϊ��������
2SO2(g)��O2(g) ![]() 2SO3(g)�� ��H����98.3 kJ��mol��1
2SO3(g)�� ��H����98.3 kJ��mol��1
��ʵ�ʹ�ҵ�����У������á���ת����������������һ��ת�����ɵ�SO2�����δת����SO2���ж���ת������������SO2��ת���ʾ�Ϊ95%��������SO2��ת����Ϊ ��
��5������Ĺ�ҵ�Ʒ������漰������Ҫ�Ļ�ѧ��Ӧ����Ӧ���豸(����¯��ת������������))��
�������豸�ֱ�ʹ��Ӧ��֮����������������ˡ�����������������������з�Ӧ��֮�������������ġ�
____________________________________________________________________��
�ڹ�ҵ�����г��ð����ᷨ����β�������Դﵽ������Ⱦ���������õ�Ŀ�ġ��û�ѧ����ʽ��ʾ�䷴Ӧԭ����(ֻд��2������ʽ����)
______________________________________________________________________
_____________________________________________________________________��
��6��ʵ���ҿ��������᳧¯��(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ��������̷�(FeSO47H2O)�������Ļ�ѧʽΪ[Fe2(OH)n(SO4)3��0.5n]m���Ʊ�������ͼ��ʾ������˵����ȷ���� ��

A��¯����FeS������������ķ�Ӧ�����ӷ���ʽΪ��4FeS+3O2+12H+�T4Fe3++4S��+6H2O
B������M�ijɷ���SO2��ͨ��˫��ˮ�õ����ᣬ��ѭ��ʹ��
C������ҺX�м���������ۣ���ַ�Ӧ����˵õ���ҺY���ٽ���ҺY�����ᾧ���ɵõ��̷�
D����ҺZ��pHӰ�������������������������pHƫС�������¾�����������������ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪�Ȼ�ѧ����ʽ��Zn(s)��1/2O2(g) ��ZnO(s) ��H1��Hg(l)��1/2O2(g) ��HgO(s) ��H2��
��Zn(s)��HgO(s)��Hg(l)��ZnO(s)����HֵΪ �����á�H1�͡�H2�Ĵ���ʽ��ʾ��
��2����Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����á���ӦA��4HCl(g)��O2(g) 2Cl2(g)��2H2O(g)������Ӧ��4mol HCl���������ų�115.6kJ���������Ҳ��ֻ�ѧ������ʾ��ͼ���£�
2Cl2(g)��2H2O(g)������Ӧ��4mol HCl���������ų�115.6kJ���������Ҳ��ֻ�ѧ������ʾ��ͼ���£�
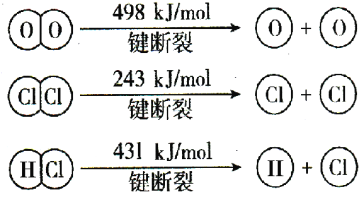
�ٷ�ӦA���Ȼ�ѧ����ʽ�� ��
�ڶϿ�1 mol H��O������Ҫ���յ�����Ϊ kJ��H2O��H��O ����HCl��H��Cl����ȣ� �ļ��ܽϴ�������H��O������H��Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
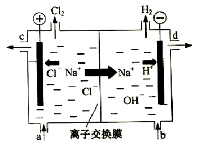
���������գ�
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ��
��2�����ӽ���Ĥ������Ϊ�� ��
��
��3�����Ʊ���ʳ��ˮ��ͼ�� λ�ò��䣬����������Һ��ͼ�� λ����������ѡ�a������b������c����d����
��4��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪3.6g̼��6.4g������ȼ�գ�����Ӧ��ľ������ų�X kJ��������֪1mol����̼��ȫȼ�շų�����ΪY kJ����1molC��O2��Ӧ����CO�������仯Ϊ
A���ų�Y kJ B���ų�(5X-5Y) kJ
C���ų�(10X-Y) kJ D������(10X-Y) kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
���̿���Ҫ�ɷ�ΪMnO2���������Ʊ��̼��仯���
��1������ұ�������̵�һ�ַ��������������̿�����Mn3O4�����������ȷ�Ӧԭ���Ƶ��̣������ȷ�Ӧ�Ļ�ѧ����ʽΪ_______________��
��2���ִ�ұ�������̵�һ�ֹ�����������ͼ��ʾ��
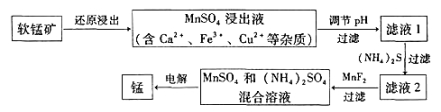
�±�Ϊt��ʱ���й����ʵ�pKsp��ע��pKsp =��lgKsp����
���� | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
���̿�ԭ�����ķ�ӦΪ��12MnO2��C6H12O6��12H2SO4 ![]() 12MnSO4��6CO2����18H2O
12MnSO4��6CO2����18H2O
���÷�Ӧ�У���ԭ��Ϊ_______��д��һ�������ԭ�������ʵĴ�ʩ��_______��
����Һ1��pH_______����������������С����������������MnSO4����Һ��pH��
�ۼ���MnF2����ҪĿ���dz�ȥ ����Ca2+��Fe3+��Cu2+����
��3����MnSO4��ȡMnCO3����MnSO4��Һ�м������NH4HCO3��Һ���÷�Ӧ�����ӷ���ʽΪ____________������MnSO4��Һ�м���(NH4)2CO3��Һ���������Mn(OH)2�����ܵ�ԭ������MnCO3(s)��2OH��(aq)![]() Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com