
普钙是目前使用最广泛的磷肥,其主要成分是( )
A.Ca5(PO4)3F
B.Ca(H2PO4)2·H2O和CaSO4
C.Ca3(PO4)2和CaHPO4
D.CaHPO4和Ca(H2PO4)2
科目:高中化学 来源: 题型:
出下列反应化学方程式,并写出该反应属于何反应类型.
(1)乙烯使溴水退色 ;
(2)苯与浓硫酸和浓硝酸的混合液共热 ;
(3)由乙炔制聚氯乙烯 ;
(4)乙烷与Cl2在光照条件下1:1反应:
(5)3﹣甲基﹣1﹣丁炔与溴的四氯化碳溶液按物质的量为1:1反应:
(6)用甲苯制2,4,6﹣三溴甲苯:
查看答案和解析>>
科目:高中化学 来源: 题型:
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。
1)三硅酸镁的氧化物形式为 ,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
2)铝元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
磷单质及其化合物有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来___________________________________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)====6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)====P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)====CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=_____________________________。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个水分子的产物,其结构式为________________________。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为___________________________。

(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为________________________。
②化学镀镍的溶液中含有Ni2+和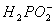 ,在酸性等条件下发生下述反应:
,在酸性等条件下发生下述反应:
(a)__________Ni2++__________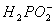 +__________
+__________ __________Ni+________
__________Ni+________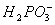 +_______
+_______
(b)6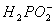 +2H+====2P+4
+2H+====2P+4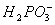 +3H2↑
+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:_______________;原理上的相同点:_______________;化学镀的优点:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)将燃烧黄铁矿的化学方程式补充完整
4________+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是__________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。计算:该铵盐中氮元素的质量分数是___________%;若铵盐质量为15.00 g,浓硫酸增加的质量为___________。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Cl、N、S等非金属元素化合物的说法正确的是…( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
⑴下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
⑵将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6
C6H12O6
b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
⑶文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,
即:CO2 HCOOH
HCOOH CH4
CH4

①写出产生H2的反应方程式 。
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是______________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是___________________,此液体具有的性质是______(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com