
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
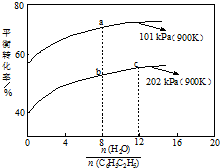 苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:
苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:| A. | a点转化率为75%,若起始向1 L恒容容器中充入1 mol 乙苯,则平衡常数为2.25 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{19}$ | |
| C. | 恒容时加入稀释剂能减小C8H10 (g)平衡转化率 | |
| D. | b点和c点温度和压强相同,所以反应速率也相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com