
【题目】氨气在工业上有广泛用途。请回答以下问题:
(1)工业上利用N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
2NH3(g) H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①相对a而言,b可能改变的条件是 ,判断的理由是__________________。
②a条件下,0~t0的平均反应速率v(N2)= mol·L-1·min-1。 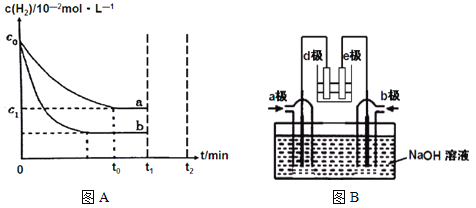
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝。
a极通入 气体(填化学式),判断的理由是___________________________________
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
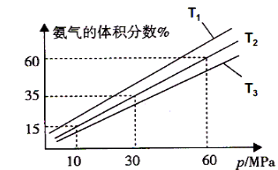
图C
①能判断N2(g)+3H2(g)![]() 2NH3(g)达到平衡的是______(填序号)。
2NH3(g)达到平衡的是______(填序号)。
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为 .
③此时N2的平衡分压为 MPa。(分压=总压×物质的量分数)
计算出此时的平衡常数Kp= 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
【答案】(1)①增大c(N2) ,a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大。②(c0-c1)/300t0
(2)NO2, e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极
(3)① bd ②K1>K2>K3 ③90.043(Mpa)-2。
【解析】
试题分析:(1)①根据图A知a、b两种条件下氢气起始浓度相同,b条件下到达平衡的时间缩短且氢气的转化率增大,相对a而言,b可能改变的条件是增大c(N2)。②a条件下,0~t0时氢气的浓度变化为(c0-c1)×10-2 mol/L,则氮气的浓度变化为(c0-c1)/300mol/L,平均反应速率v(N2)= (c0-c1)/300t0mol·L-1·min-1。
(2)根据题意知该电池的电池反应为8NH3+6NO2==7N2+12H2O,粗铝的精炼,e极为精铝,则e为电解池的阴极,d为电解池的阳极,a极为电池的正极,发生还原反应,通入的气体为NO2。
(3)① a.反应在等温等压条件下进行,容器内压强不随时间变化而变化,压强不变不能说明反应达到平衡,错误;b.该反应正向为气体物质的量减小的反应,反应在等温等压条件下进行,随着反应的进行容器内气体的物质的量逐渐减小,容器的体积逐渐减小,混合气体的密度逐渐减小,当密度不再发生变化说明反应达到平衡状态,正确;c.v正(N2)=3v逆(H2),v正(N2):v逆(H2)=3 ,不等于化学计量数之比,反应未达平衡状态,错误;d.该反应正向为气体物质的量减小的反应,随着反应的进行,混合气体的物质的量逐渐减小,平均相对分子质量逐渐增大,当混合气体的平均摩尔质量不再发生变化说明反应达到平衡状态,正确,选bd;②合成氨的反应正向为放热反应,升高温度平衡逆向移动,氨气的体积分数减小,结合图C知温度:T1<T2<T3,则K1、K2、K3由大到小的排序为K1>K2>K3;③利用三行式分析。设转化的氮气的物质的量为x。
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始物质的量(mol)9 23 0
转化物质的量(mol)x 3x 2x
平衡物质的量(mol)9-x 23-3x 2x
根据阿伏伽德罗定律:等温等压条件下,气体的体积之比等于气体的物质的量之比。根据图C知体系在T2、60MPa下达到平衡时氨气的体积分数为60%,则2x/(32-2x)=60%,解得x=6mol,平衡时N2的物质的量为3mol,气体总物质的量为20mol,此时N2的平衡分压为60MPa×3/20=9Mpa,同理计算H2的平衡分压为15Mpa,NH3的平衡分压为36Mpa,则平衡常数Kp=p2(NH3)/p(N2)p3(H2)=362÷(9×153)=0.043(Mpa)-2。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】(1)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用
能,还能为农业生产提供优良的肥料。已知: 标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为 。
②如果上述反应生成的是水蒸气,则反应放出的热量 4448kJ。(填“>”或“<”或“=”)
(2)已知拆开1 mol H-H键、1 molN≡N、1 mol N-H键分别需要吸收的能量为436 .4kJ、941.3 kJ、390.5 kJ。则由1 mol NH3 分解生成氢气和氮气需要 (填“放出”或“吸收”) kJ的热量。
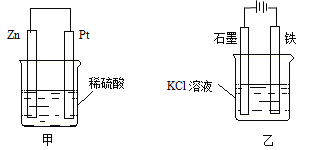
(3)在生产和生活中经常遇到化学能与电能的相互转化。在下列甲、乙两装置中,甲中负极电极反应式为 ;乙中铁电极的电极反应式为 ,铁电极发生 反应(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ka 为平衡常数,pKa=﹣lgKa,25℃时,H2A的 pKa1 =1.85,pKa2=7.19。用 0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如下图所示(曲线上的数字为 pH)。下列说法不正确的是

A.a 点所得溶液中;2c(H2A)+c(A2-)=0.002mol
B.b 点所得溶液中:c(H2 A)+c(H+)=c(A2-)+C(OH-)
C.C 点所得溶液中:c(Na+)<3c(HA-)
D.d 点所得溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
已知:![]()
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
苯胺 | -6 | 184.4 | 微溶于水 |
醋酸 | 16.6 | 118 | 易溶于水 |
实验步骤如下:
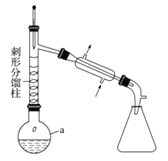
步骤1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全。
步骤3:趁热将反应混合物倒入盛有100 mL 冷水的烧杯中,冷却后抽滤、洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)仪器a的名称为 ,所选仪器a的最佳规格是 (填序号)。
A. 25 mL B.50 mL C.100 mL D.250 mL
(2)实验中加入少许锌粉的目的是 。
(3)步骤2中,控制温度计读数在105℃左右的原因是 。
(4)判断反应已基本完全的方法为 。
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是 。
(6)步骤4中粗产品进一步提纯,该提纯方法是 。
(7)本次实验的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为元素周期表短周期的一部分。E原子的电子层数为n,最外层电子数为2n+l。下列叙述不正确的是( )
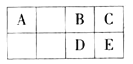
A. C和E氢化物的热稳定性和还原性均依次减弱
B. A与B形成的阴离子可能有AB32-、A2B42-
C. AD2分子中每个原子的最外层均为8电子结构
D. A、D、E的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:


(1)仪器A中发生反应的化学方程式是______;装置B中的试剂是_______。
(2)若撤去装置C,可能导致装置D中副产物_____(填化学式)的量增加;装置D可采用 加热的方法以控制反应温度在70℃左右。
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________。
(4)装置E中可能发生的无机反应的离子方程式有_________________。
(5)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol·L-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 mo1·L-1Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为_________。(CCl3CHO的相对分子质量为147.5)滴定的反应原理:CCl3CHO+OH-==CHCl3+HCOO-、HCOO-+I2==H++2I-+CO2↑ 、I2+2S2O32-==2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka (CH3COOH)= 1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为
据此填写下列空格。
(1)该物质苯环上一氯代物有________种;
(2)1 mol该物质和溴水混合,消耗Br2的物质的量为________mol;
(3)1 mol该物质和H2加成需H2________mol;
(4)下列说法不正确的是________。
A.该物质可发生加成、取代、氧化等反应
B.该物质与甲苯属于同系物
C.该物质使溴水褪色的原理与乙烯相同
D.该物质使酸性KMnO4溶液褪色发生的是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。
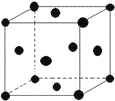
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
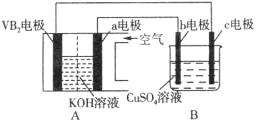
A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,c电极表面先有红色物质析出,后有气泡产生
D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com