


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| A、常温下,28gFe与足量的浓硝酸反应,转移的电子数为1.5NA |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1mol氖气含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/LFeCl3溶液中Fe3+数目为NA个 |
| B、2g氢气所含原子数目为NA |
| C、在常温常压下,11.2L氮气所含的原子数目为NA |
| D、17gNH3所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:| 元素 | 元素相关信息 |
| a | 其单质的熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体 |
| b | 原子核外有7种运动状态不同的电子 |
| c | 电负性最大 |
| d | 一种核素的质量数为35,中子数为18 |
| e | 基态原子的核外电子排布中未成对的电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
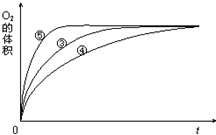 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
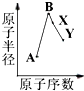 A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.
A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
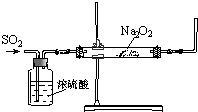 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | / | |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.68 g硫酸铜,加入500 mL水 |
| B、称取12.5 g胆矾配成500 mL溶液 |
| C、称取8.0 g硫酸铜,加入500 mL水 |
| D、称取12.0 g胆矾配成500 mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com