

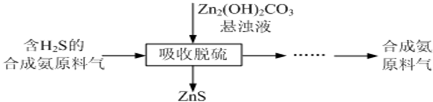
分析 氧化锌矿粉(主要含ZnO、FeCO3、CuO等)加入50%~60%硫酸酸浸,溶液中含有Zn2+、Fe2+、Cu2+等金属离子,加入双氧水将Fe2+氧化成Fe3+,加入试剂X调节溶液pH=5.4,使铁离子沉淀,在调节pH时不能能引入新的杂质,所以试剂X可以用ZnO、ZnCO3等,过滤得滤渣1为Fe(OH)3,在滤液中加入过量Zn,用锌还原出铜离子,除去铜,过滤得滤渣2为铜和过量的锌,滤液中加入碳酸铵调节pH6.0~6.5,可生成Zn2(OH)2CO3,同时生成硫酸铵,以此解答该题.
解答 解:氧化锌矿粉(主要含ZnO、FeCO3、CuO等)加入50%~60%硫酸酸浸,溶液中含有Zn2+、Fe2+、Cu2+等金属离子,加入双氧水将Fe2+氧化成Fe3+,加入试剂X调节溶液pH=5.4,使铁离子沉淀,在调节pH时不能能引入新的杂质,所以试剂X可以用ZnO、ZnCO3等,过滤得滤渣1为Fe(OH)3,在滤液中加入过量Zn,用锌还原出铜离子,除去铜,过滤得滤渣2为铜和过量的锌,滤液中加入碳酸铵调节pH6.0~6.5,可生成Zn2(OH)2CO3,同时生成硫酸铵,
(1)“酸浸”时保持H2SO4过量,可使固体充分溶解,且防止Zn2+、Fe2+、Cu2+等金属离子水解,
故答案为:提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解);
(2)氧化时是加入双氧水将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据上面的分析可知,在调节pH时不能能引入新的杂质,所以试剂X可以用ZnO、ZnCO3等,故选BC,渣1为Fe(OH)3,
故答案为:BC;Fe(OH)3;
(4)根据上面的分析可知,加入碳酸铵调节pH6.0~6.5,可生成Zn2(OH)2CO3,同时生成(NH4)2SO4,可用作化肥,
故答案为:(NH4)2SO4;
(5)由流程可知碱式碳酸锌吸收硫化氢可生成ZnS,反应的化学方程式为Zn2(OH)2CO3+2H2S=2ZnS+CO2+3H2O,
故答案为:Zn2(OH)2CO3+2H2S=2ZnS+CO2+3H2O.
点评 本题侧重于学生的分析、实验能力的考查,题目主要依据流程图中涉及的化学知识、化学原理来设计问题.能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 | |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加KSCN溶液; 往B中滴加淀粉溶液. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2C(H+)-2C(OH-)=C(ClO-)-C(HClO) | |
| C. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  实验室用装置制取氨气 | |
| B. |  装置X若为CCl4,可用于吸收氨气并防止倒吸 | |
| C. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| D. |  装置是原电池,铁电极为负极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com