
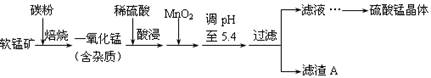
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
 、
、 ,显然前者大于后者,所以上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS。
,显然前者大于后者,所以上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是Mn(OH)2>MnCO3>MnS。

科目:高中化学 来源:不详 题型:单选题

| 编号 | a | b | c | d |
| ① | Na2O | Na2O2 | Na | NaOH |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| ③ | FeCl2 | FeCl3 | Fe | CuCl2 |
| ④ | NO | NO2 | N2 | HNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
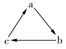 (“→”表示一步转化)关系相互转化的是( )
(“→”表示一步转化)关系相互转化的是( )| 选项 | a | b | c |
| A | H2O | O2 | Fe(OH)3 |
| B | Na | Na2O | NaCl |
| C | C | NO2 | HNO3 |
| D | FeCl2 | Fe | FeCl3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向KMnO4溶液中滴加盐酸,KMnO4溶液的氧化能力增强。说明盐酸具有氧化性 |
| B.向澄清的AlCl3稀溶液中加入NaOH浓溶液,振荡,溶液仍为澄清。说明该两种溶液混合是物理变化 |
| C.向FeCl3溶液中加入过量Cu粉,振荡、静置,溶液由黄色变为绿色。说明Fe3+具有氧化性 |
| D.向CaCl2溶液中通入CO2,不产生白色沉淀。说明CaCO3能溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
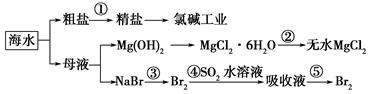
| A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 |
| B.工业上通过氯碱工业制取金属钠 |
| C.从第③步到第⑤步的目的是浓缩、富集溴单质 |
| D.第②步的反应条件是高温加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C.碘是人体必须微量元素,所以要多吃富含高碘酸的食物 |
| D.黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com