
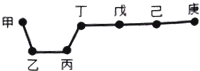
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲与己形成的化合物一定是离子化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
分析 由短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素,则戊为N元素,己为O元素,结合位置可知,甲为可能为H,丁为C,庚为F,乙为Mg,丙为Al,然后结合元素周期律及元素化合物知识来解答.
解答 解:由短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素,则戊为N元素,己为O元素,结合位置可知,甲可能为H,丁为C,庚为F,乙为Mg,丙为Al,
A.甲与己形成的化合物为水时,为共价化合物,故A错误;
B.非金属性越强,氢化物越稳定,则简单气态氢化物的稳定性:庚>己>戊,故B正确;
C.氢氧化铝与强酸、强碱反应,则乙、丙、丁的最高价氧化物水化物不能相互反应,故C错误;
D.庚为F,没有正价,故D错误;
故选B.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的推断为解答的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
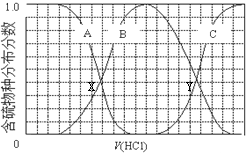
| A. | 含硫物种B表示HS- | |
| B. | 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] | |
| C. | X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值 | |
| D. | NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-═CuS↓+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
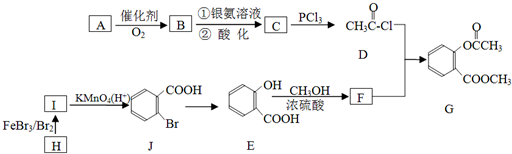
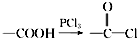 ,请回答以下问题:
,请回答以下问题: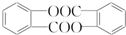 .
.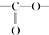 结构
结构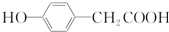 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
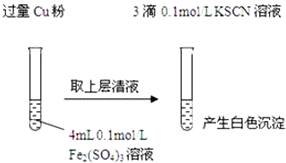
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的氨水和NaOH溶液各1.0 L含有的OH-数目均为0.1NA | |
| B. | 常温常压下,由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 22 gD218O分子中,含有质子数和中子数分别为10NA和12NA | |
| D. | 标准状况下,22.4 L CCl4中含有的C-Cl键数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③⑤⑥② | B. | ①⑤③④⑥② | C. | ①③④⑥⑤② | D. | ①③⑤⑥④② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com