
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。

已知:铅蓄电池在放电时发生下列电极反应:
负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式__。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为__极。
(3)用铅蓄电池电解1L饱和食盐水时
①若收集到11.2L(标准状况下)氯气,则至少转移电子__mol。
②若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为___L。
【答案】2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 正 1 22.4
2NaOH+Cl2↑+H2↑ 正 1 22.4
【解析】
(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)C极一侧滴酚酞试液不变红色,说明该极无OH-生成,C极是阳极;
(3)①依据电解氯化钠生成氯气的电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算。
(1) 惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,化学方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(2)C极一侧滴酚酞试液不变红色,说明该极无OH-生成,C极是阳极,阳极与电源正极相连,则A是正极,故答案为:正;
(3)①电解氯化钠生成氯气的电极反应为2Cl--2e-=Cl2↑,收集到11.2L(标准状况下)氯气物质的量为0.5mol,转移电子物质的量为1mol,故答案为:1;
②蓄电池消耗H2SO42mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸转移电子2mol,根据电子守恒,电解食盐水阴极电极反应2H++2e-=H2↑,转移电子也为2mol,则生成氢气1mol,标准状况体积为22.4L,故答案为:22.4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】南开大学的周其林院士及其团队凭借“高效手性螺环催化剂”的发现,获得了2019年度国家自然科学奖一等奖。一种手性螺环分子的结构简式如图所示。下列关于该有机物说法错误的是

A.分子式为C16H12N2O2
B.分子中除氢原子之外的所有原子可能共平面
C.分子中只有一个手性碳原子
D.在酸性条件下能水解,且水解产物有8种化学环境不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
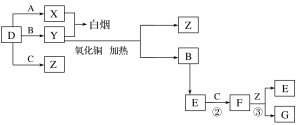
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。

【答案】H2 NH3 NO 2NH3+3CuO![]() N2+3Cu+3H2O 6NO+4NH3
N2+3Cu+3H2O 6NO+4NH3![]() 5N2+6H2O 有 二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀
5N2+6H2O 有 二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀
【解析】
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3,据此解答。
A、B、C、D是四种常见气体单质.E的相对分子量比F的小16,且F为红棕色,可推知F为NO2,E为NO,C为O2,B为N2,结合转化关系,气体单质D、A反应得到X,气体单质D与B反应得到Y,X与Y反应冒白烟,应是氨气与HCl反应,可推知D为氢气、A为氯气、X为HCl、Y为氨气,D与C反应生成Z为水,F与Z反应生成G为HNO3;
(1)由上述分析可知,D的化学式为H2,Y的化学式为NH3,E的化学式为NO;
(2)NH3与氧化铜反应,每生成1molN2消耗3mol氧化铜,还原产物中Cu应是化合价为a,则:3(2-a)=2×3,解得a=0,故生成Cu,该反应的化学方程式为:2NH3+3CuO ![]() N2+3Cu+3H2O;
N2+3Cu+3H2O;
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为4NH3+6NO ![]() 5N2+6H2O;
5N2+6H2O;
(4)二氧化氮与水反应生成硝酸,硝酸可将二氧化硫或亚硫酸氧化成硫酸,硫酸与氯化钡反应可生成硫酸钡沉淀,故气体NO2和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中,洗瓶中有沉淀生成。
【题型】推断题
【结束】
20
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素以C—C键构成了有机界,硅元素以![]() 键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
键构成了整个矿物界,锗元素是重要的国家战略资源。碳族元素组成了有机界、无机界和当代工业。回答下列问题:
(1)基态锗(![]() )原子的核外电子排布式为
)原子的核外电子排布式为![]() _____;
_____;![]() 分子空间构型是__________。
分子空间构型是__________。
(2)![]() 发生水解的机理如图:
发生水解的机理如图:
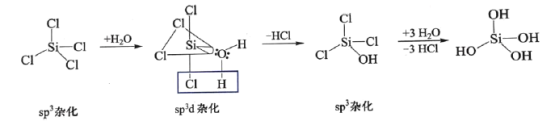
![]() 不能按照上述机理发生水解反应,原因是____________________。
不能按照上述机理发生水解反应,原因是____________________。
(3)金刚石熔点为4440℃,晶体硅熔点为1410℃,金刚石熔点比晶体硅高的原因是_______。
(4)C和![]() 经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
经常形成原子晶体,原子晶体的配位数普遍低于离子晶体,原因是_____。
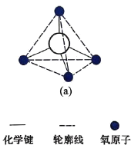
(5)在硅酸盐中,![]() 四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中
四面体[如图(a)和(b)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(c)为片层状结构的多硅酸根,其中![]() 原子的杂化方式为______,化学式为_______。
原子的杂化方式为______,化学式为_______。


(6)铝硅酸盐分子筛在化工领域有重要的应用。铝硅酸盐结构中![]() 价铝部分地置换
价铝部分地置换![]() 四面体结构中
四面体结构中![]() 价的硅。从结构角度分析
价的硅。从结构角度分析![]() 价铝能够置换
价铝能够置换![]() 价硅的原因是_________。
价硅的原因是_________。
(7)石墨采取六方最密堆积方式,晶胞结构如图。晶胞参数为底边长![]() ,高
,高![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则石墨晶体的密度为_______
,则石墨晶体的密度为_______![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4![]() MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A. MoS2煅烧产生的尾气可直接排空
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基)。

则下列有关叙述正确的是( )
A.反应①属于加成反应B.1 mol W最多可与3 mol NaOH反应
C.X、Y、W、Z都能与NaOH溶液反应D.可用溴水或FeCl3溶液鉴别出X和W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由链状化合物B(C4H4O4)通过以下反应制取。通常状况下B为无色晶体,与碳酸氢钠溶液反应生成C4H2O4Na2,B没有支链。

下列说法正确的是( )
A.B中只含一种官能团:羧基
B.反应①属于取代反应
C.反应②属于加成反应
D.天门冬氨酸的结构简式为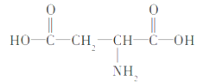
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
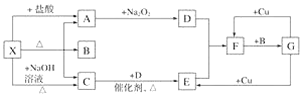
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水制备金属镁的流程如图所示,请据图回答下列问题:

(1)贝壳主要成分的化学式是__。
(2)第②步是用生石灰和水反应制取石灰乳(主要成分是氢氧化钙)请写出制取石灰乳的化学方程式:__,基本反应类型是__。
(3)第③步是将沉淀出的氢氧化镁与盐酸反应生成氯化镁,写出该反应的化学方程式:__,该反应基本类型是__。
(4)第④步是无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式:___,反应基本类型是__。
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量,确定海水中的MgCl2已全部转化为Mg(OH)2的方法:取上层清液少量,向其中加入氢氧化钠溶液,观察到__。
(6)海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化原因:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com