
【题目】已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等
C.2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
【答案】B
【解析】A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,A不符合题意;
B、条件一定,燃烧热为定值,与物质的量无关,所以25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等,B符合题意;
C、题目中第二个方程的2倍为:2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=﹣452 kJ/mol,本题中的CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452,但是△H>﹣452 kJ/mol,C不符合题意;
D、反应Na2O2(s)+CO2(g)═Na2CO3(s)+ ![]() O2(g)△H=﹣226kJmol﹣1,每有1molNa2O2(s)反应.转移1mol电子即转移6.02×1023电子,放热226KJ,但是题目问的是CO(s)与Na2O2(s)反应,根据盖斯定律可得反应的方程式为:CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣509kJ/mol;1mol物质参与反应时,转移的电子数为0.5mol,D不符合题意;
O2(g)△H=﹣226kJmol﹣1,每有1molNa2O2(s)反应.转移1mol电子即转移6.02×1023电子,放热226KJ,但是题目问的是CO(s)与Na2O2(s)反应,根据盖斯定律可得反应的方程式为:CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣509kJ/mol;1mol物质参与反应时,转移的电子数为0.5mol,D不符合题意;
所以答案是:B


科目:高中化学 来源: 题型:
【题目】某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度分析,下列选项正确的是( ) 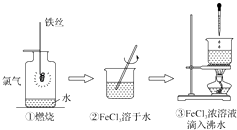
A.实验①、②所涉及的物质均为电解质
B.实验②、③均为放热反应实验
C.②、③均未发生氧化还原反应
D.实验①、③反应制得的物质均为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞结构和生物体内化合物的叙述正确的是
A.细菌代谢速率极快,其细胞器膜为酶提供了附着位置
B.人体细胞内有细胞核、线粒体和叶绿体
C.植物体内的无机盐大多数以离子形式存在
D.脂质中的磷脂参与构成核糖体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
周期 族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图_________。
(2)②、③、⑤的离子半径由大到小的顺序为___________。
(3)元素④和⑥形成的化合物的电子式:_____________。
(4)元素②和⑤形成的化合物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方塑式为2NO(g) + Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____( 填增大、减少、不变).
(2)己知几种化学键的键能数据如下表( 亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl一Cl | Cl一N | N=O |
键能/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol,则a=_______。
2ClNO(g) △H=-111kJ/mol,则a=_______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:

①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________mol/(L.min).
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___点,当n(NO)/n(Cl2)=1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成 NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成 Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有 Fe2+。若误食亚硝酸盐(如NaNO2 ),则导致血红蛋白中的 Fe2+转化为 Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将 Fe3+还原为 Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,能用来区分NaNO2和NaCl的是_____(填序号)。
A.分别溶于水看溶解情况
B.在酸性条件下加入KI—淀粉溶液来区别
C.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和 HCl,请写出反应的离子方程式:____________________________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是______(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为 2∶1,试配平下列方程式:________________
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B![]() C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是

A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0

①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com