
.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A.H2O(g)===H2(g)+ O2(g) ΔH=-485 kJ·mol-1
O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+ O2(g) ΔH=+485 kJ·mol-1
O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1

科目:高中化学 来源: 题型:
烟道气中的CO2可用于合成甲醇和甲醚。
(1)下图所示为其中的一种方法:
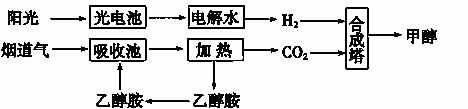
①用光电池电解水时,阳极的电极反应式为__________________________________。
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显________(填“酸”“碱”或“中”)性。
③已知,CH3OH(l)+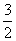 O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
H2(g)+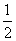 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为
________________________________________________________________________。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是________(填序号)。
a.生成1 mol CH3OCH3(g)的同时,生成3 mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1∶3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比 | 500 K | 600 K | 700 K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
上述反应的化学平衡常数的表达式为__________。该反应的焓变ΔH________0(填“>”、“<”或“=”,下同),若使a>45%,则x________1.5。
③在一定温度下,向体积为0.5 L的密闭容器中加入2 mol CO2和6 mol H2,20 min后达到平衡,测得平衡时CH3OCH3为0.5 mol,则该反应的反应速率v(CO2)=____mol·L-1·min-1,H2的转化率α(H2)=______;加入催化剂,v(CO2)________(填“增大”、“减小”或“不变”,下同),α(H2)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1814年戴维发现了一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。
(1)氯元素在元素周期表中的位置是_________;ICl的电子式为____________。
(2)ICl与冷的NaOH稀溶液反应的离子方程式为____________________。
(3)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,发生化学反应的化学方程式为_____________________。
(4)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_________________________。下列说法正确的是______。
a.ICl3分子中各原子均达到8电子稳定结构
b.由反应KClO3+I2+6HCl=2ICl3+KCl+3H2O,可知还原性:KClO3>ICl3
c.ICl与乙烯反应的化学方程式为CH2=CH2+ICl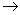 ICH2CH2Cl
ICH2CH2Cl
d.ICl与苯反应制取碘苯的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是关于氯水的叙述,正确的是
A.新制氯水中只含C12和HClO分子 B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2 D.氯水放置数天后,PH值将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小
C.化学反应中能量变化,通常主要表现为热量的变化------放热或者吸热
D.凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.下列有关说法不正确的是________。
A.相同类型的离子晶体,晶格能越大,形成的晶体越稳定
B.NH3和H3O+是等电子体,因此结构都是三角锥形
C.邻羟基苯甲醛沸点低于对羟基苯甲醛,原因是前者存在分子内氢键后者存在
分子间氢键
D.H3O+、HF2-和[Ag(NH3)2]+中均存在配位键
Ⅱ.碳及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为 。第四周期与其有相同
未成对电子数的过渡金属有 (填元素符号)
(2)第一电离能:C、N、O、F四种元素由大到小顺序___ _ ,
原因是 ,
HCN、NF3分子构型分别是 。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是__________________________。
(4)C60的晶体中,分子为面心立方堆积,已知晶胞中C60分子中心间的最短距离为
d cm,可计算C60晶体的密度为________g/cm3。
(5)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中 ②过量NaOH溶液和明矾溶液馄合 ③少量Ca (OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 mol·L-1 |
| H2CO3 | K1=4.3×10-7 mol·L-1 |
| K2=5.6×10-11 mol·L-1 |
A.[HCO ]>[ClO-]>[OH-]
]>[ClO-]>[OH-]
B.[ClO-]>[HCO ]>[H+]
]>[H+]
C.[HClO]+[ClO-]=[HCO ]+[H2CO3]
]+[H2CO3]
D.[Na+]+[H+]=[HCO ]+[ClO-]+[OH-]
]+[ClO-]+[OH-]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com