
【题目】写出下列反应的化学方程式,并指出反应类型。
(1)溴苯的制备_________________________________________________(_____________)。
(2)用甲苯制备TNT _____________________________________________(_____________)。
(3)由丙烯制备聚丙烯____________________________________________(_____________)。
(4)溴乙烷与氢氧化钠的乙醇溶液加热______________________________(_____________)。
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
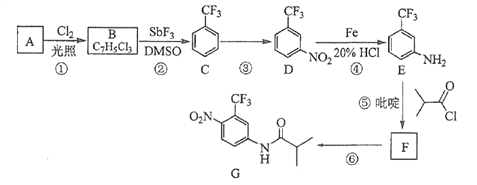
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。FeSO47H2O广泛用于医药和工业领域,以下是测定某补血剂(有效成分为FeSO47H2O)中铁元素含量的流程图。根据题意完成下列填空:

(1)人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。补血剂与维生素C一起服用,有利于+2价铁的吸收。由此可推知,维生素C具有____________(填“氧化性”或“还原性”)。
(2)步骤Ⅱ需要100mL1mol·L-1的稀硫酸,实验室用质量分数为98%的浓硫酸(密度为1.84g·cm-3)来配制,需用量筒量取浓硫酸____________mL。
(3)步骤Ⅲ所得滤液中滴加KSCN溶液后滤液变为红色,则滤液中含有____________(填离子符号)。检验滤液中还存在Fe2+,应选用的试剂为____________(填字母)
A.NaCl溶液B.酸性KMnO4溶液C.NaOH溶液
(4)步骤Ⅳ加入过量H2O2的目的是____________(用离子方程式表示)。
(5)步骤Ⅵ的一系列操作依次是:①过滤②洗涤③____________④冷却⑤称量⑥恒重操作,操作⑥的目的是____________。
(6)假设实验无损耗,则每片补血剂含铁元素的质量为____________g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。

试回答下列问题:
(1)该反应的化学方程式为________。
(2)0~t1s内气体B的平均反应速率为________。
(3)(t1+10)s时,B的物质的量分数为______,此时v正(A)_____v逆(B)(填“>”“<”或“=”),D点是否处于平衡状态_________(填“是”或“否”)。
(4)下列关于该反应的说法正确的是________ (填序号)。
a.到达t1时刻该反应已停止
b.在t1时刻之前,气体B的消耗速率大于它的生成速率
c.在t1时刻,气体C的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-====4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2====2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是__________。
(3)10种元素中最高价氧化物的水化物,酸性最强的是__________。
(4)元素⑦组成的含非极性键的分子的电子式:__________。
(5)区分①、②的碳酸正盐的简单实验方法__________。
(6)①和⑤最高价氧化物对应的水化物相互反应的离子方程式为__________。
(7)③的单质与⑥的最高价氧化物反应的方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见气体在标准状况下的密度为1.25 g·L-1。
(1)该气体的相对分子质量为________。
(2)若该气体的分子式为A2型,其名称为________;
若该气体的分子式为AB型,其名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列相关说法不正确的是( )
,下列相关说法不正确的是( )
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸能与钠、镁等活泼金属发生置换反应生成H2
D. 1mol苹果醋与Na2CO3溶液反应一定消耗2molNa2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH![]() CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
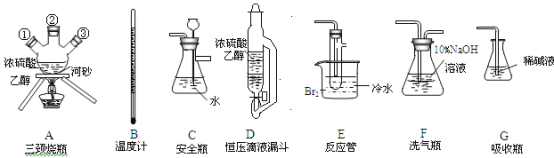
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接__接__接___接___。
(2)温度计水银球的正确位置是_________。
(3)装置D与分流漏斗相比,其主要优点是_______。
(4)装置C的主要作用是_______,装置F的作用是__________。
(5)在反应管E中进行的主要反应的化学方程式为________。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是_______________。若将装置F拆除,在E中的主要反应为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com