
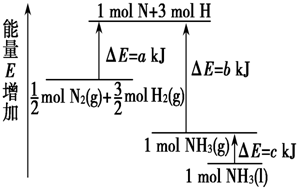
| A. | N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=2(b-a) kJ•mol-1 | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(l)△H=2(b+c-a) kJ•mol-1 | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=2(a+b) kJ•mol-1 |
分析 根据反应热等于反应物旧键断裂吸收的总能量减去生成物新键形成所放出总能量计算反应热,然后根据并热化学方程式的书写方法写出热化学方程式,注意反应物的物质的量和生成物的聚集状态.
解答 解:由图可以看出,$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)断键吸收的能量为akJ,形成1molNH3(g)的放出的能量为bkJ,所以$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
根据盖斯定律可知:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(l)△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,N2(g)+3H2(g)=2NH3(l)△H=2(a-b-c)kJ/mol,
故选A.
点评 本题考查热化学方程式的书写,题目难度不大,注意书写热化学方程式的注意事项以及反应热的计算方法,明确反应中图象表示的含义以及盖斯定律的应用方法是解题的关键.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质的 化学式 | NaOH(浓) | C2H5OH(酒精) | H2SO4 (浓) | NH4NO3 |
| 危险警 告标签 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ①④⑤⑦ | D. | ①②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(气)+3H2(气)?2NH3(气);△H<0 | B. | C(固)+CO2(气)?2CO(气);△H>0 | ||
| C. | N2(气)十O2(气)?2N0(气);△H>0 | D. | CaCO3(固)?CaO(固)+CO2(气);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
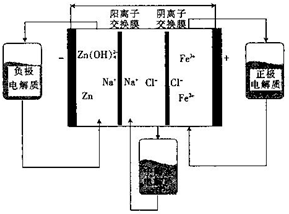
| A. | 放电时,Na+从中间室进入负极室 | |
| B. | 充电时,Cl-从阳极室进入中间室 | |
| C. | 放电时,负极的电极反应为Zn+4OH--2e-=Zn(OH)42- | |
| D. | 充电时,阳极的电极反应为Fe3++e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热用△H3表示,则△H3<△H1 | |
| B. | 碳的燃烧热用△H3表示,则△H3>△H1 | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
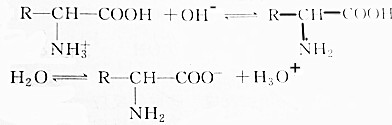
| A. | 增大溶液的pH,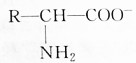 浓度减小 浓度减小 | |
| B. | 降低溶液的pH,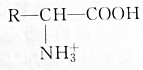 浓度减小 浓度减小 | |
| C. | 如溶液的pH适当,两种氨基酸离子的浓度可能相同 | |
| D. | pH改变,对电离方式无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com