
【题目】实验是化学研究的基础。关于下列各实验装置图的叙述中正确的是( )

A. 装置①常用于分离互不相溶的液态混合物
B. 装置②可用于吸收氨气,且能防止倒吸
C. 用装置③不可以完成“喷泉”实验
D. 用装置④稀释浓硫酸和铜反应冷却后的混合液
科目:高中化学 来源: 题型:
【题目】氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成的硫酰氯的反应和实验装置如下所示:SO2(g)+Cl2(g) ![]() SO2Cl2(1) ΔH=-97.3KJ/mol。
SO2Cl2(1) ΔH=-97.3KJ/mol。

已知: 一般条件下,硫酰氯为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置会分解。
请回答下列问题:
(1)仪器己中盛放的试剂主要用于排气,该试剂最合适的是___________(填名称)。
(2)①装置庚中的药品最合适的是________(填字母);
a.五氧化二磷 b.碱石灰 c.无水氯化钙 d.硅胶
②装置丙的冷凝管中出水口是_______(填标号)
(3)活性炭的作用是___________;装置乙和丁中盛有相同的化学试剂,该试剂是__________,若缺少装置乙和丁,装置丙中会发生副反应,副反应的化学方程式是______________________。
(4)为提高本实验的硫酰氯的产率,在实验操作中还需要注意的有______。
a.控制气流速度,宜慢不宜快
b.保证装置的气密性良好
c.先向装置丙中通入一种气体,排出空气后再通入另一种气体
d.先通气体,再通冷凝水
(5)写出硫酰氯在潮湿空气中“发烟”时生产的新物质的化学式:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如下图所示,下列说法中不正确的是

A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子数与碳碳键个数的比为1:4
D. 铜晶体为面心立方最密堆积,该晶体中含有正八面体空隙和正四面体空隙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:

回答下列问题:
(1)B的分子式是___________,C中含有的官能团名称是 ____________。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%,则D的结构简式为___________,⑥的反应类型是________________。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:____________________________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:___________________。
i .含有苯环和![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)________________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备 的合成流程图:_______________________________________
的合成流程图:_______________________________________
合成流程图示例如下:CH2 = CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种重要的化工原料,温度在350℃以上容易分解。利用反应Ca(s)+O2=CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:
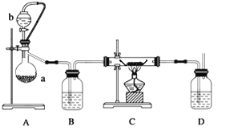
(1)装置A中反应的化学方程式为_________;
(2)装置D中盛有的液体是浓硫酸,其作用一 :____________;二:___________。
(3)仪器安装后应进行的实验操作:
a.通入氧气b.检查装置气密性c.加入药品d.停止通氧气e.点燃酒精灯f.熄灭酒精灯g.冷 却至室温,正确的操作顺序为_____________。
(4)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂,设计试验检验钙的燃烧产物中是否含有过氧化钙____________________。(简要说明现象和结论)(限选试剂:酸化的FeCl2溶液、KSCN溶液、稀硝酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在水溶液中大量共存的一组离子是( )
A.H+、I-、NO3-、CO32-
B.Ag+、Fe3+、Cl-、SO42-
C.K+、SO42-、Cu2+、NO3-
D.Fe2+、OH-、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
【答案】(1)氢(2)第2周期ⅣA族(3)Cl
(4) HClO+H2O+SO2=H2SO4+HCl
HClO+H2O+SO2=H2SO4+HCl
【解析】试题分析:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,据此答题.
解:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,
(1)根据上面的分析可知,甲、乙、丙中含有共同元素是氢元素,
故答案为:氢;
(2)B为碳元素,在周期表中第二周期第IVA族,
故答案为:第二周期第IVA族;
(3)上述元素的原子M层有一个未成对p电子的是氯元素,
故答案为:Cl;
(4)丙为次氯酸,它的电子式为![]() ,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
故答案为:![]() ;HClO+H2O+SO2=H2SO4+HCl.
;HClO+H2O+SO2=H2SO4+HCl.
【题型】推断题
【结束】
19
【题目】现有部分前36号元素的性质或原子结构如下表
| 元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)常温下,用![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图
溶液所得滴定曲线如图![]() 下列说法正确的是
下列说法正确的是![]()
![]()

A. 点![]() 所示溶液中:
所示溶液中:![]()
B. 点![]() 所示溶液中:
所示溶液中:![]()
C. 点![]() 所示溶液中:
所示溶液中:![]()
D. 滴定过程中可能出现:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com