
分析 相同条件下,气体的体积之比等于其物质的量之比,同一反应中,参加反应的各物质的物质的量之比等于其计量数之比,再结合质量守恒确定A化学式.
解答 解:相同条件下,气体的体积之比等于其物质的量之比,同一反应中,参加反应的各物质的物质的量之比等于其计量数之比,所以参加反应的A、O2、F2的计量数之比=10mL:15mL:10mL=2:3:2,再结合质量守恒定律得A中含有3个O、2个F原子,O电负性小于F元素,所以二者形成的化合物A中O显正化合价、F元素显负化合价,所以A的化学式为O3F2,
故答案为:O3F2;阿伏加德罗定律、质量守恒.
点评 本题考查阿伏伽德罗定律及其推论,明确阿伏伽德罗定律、质量守恒定律内涵即可解答,任何化学反应都遵循质量守恒定律,注意反应方程式中参加反应的气体体积与其计量数的关系,题目难度中等.


科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}、高温}{→}$SiCl4$\stackrel{H_{2}、高温}{→}$Si | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2 $\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
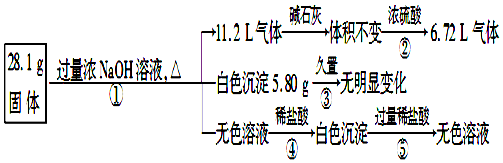
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
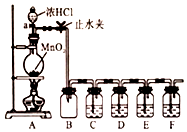 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com