
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
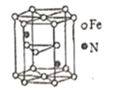
(5)氮化铁晶体的晶体结构示意图如图所示。该晶体中铁、氮的微粒个数之比为______。
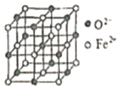
(6)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
【答案】1s22s22p63s23p63d5或[Ar] 3d5 N>O>S sp2 分子晶体 正四面体形 10NA CN- 或C22- 3∶1 12 
【解析】
根据原子或离子的核外电子排布规律分析解答;根据等电子体的概念分析解答;用“均摊法”确定晶胞中所含微粒的个数。
(1) Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子和3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5或[Ar] 3d5;
故答案为1s22s22p63s23p63d5或[Ar] 3d5;
(2) 根据同周期同主族元素性质递变规律判断,由于同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大,得N>O;又由于同主族由上到下元素原子的第一电离能逐渐减小,得O>S ,所以N、O、S三种元素的第一电离能从大到小的顺序为N>O>S;苯环中的C形成3个σ键,无孤电子对,所以苯酚中碳原子的杂化轨道类型为sp2杂化;
故答案为:N>O>S,sp2杂化;
(3) FeCl3的熔点为306℃,沸点为315℃,熔沸点较低,所以 FeCl3的晶体类型是分子晶体; SO42-中S原子价层电子对=4+![]() (6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
(6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为分子晶体,正四面体;
(4) 一个CO分子中含有一个σ键,Fe和CO形成配位键,配位键也是σ键,因此1molFe(CO)5分子中含有10molσ键;等电子体是指价电子数和原子数相同的分子、离子或原子团。与CO互为等电子体的离子可能是CN-或C22-;
故答案为10 ,CN-或C22-;
(5) 氮化铁晶胞为六棱柱,顶点贡献率为![]() ,棱点贡献率为
,棱点贡献率为![]() ,面点贡献率为
,面点贡献率为![]() ,观察晶胞知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,两个氮原子位于体内,所以该晶胞中Fe原子个数为:12×
,观察晶胞知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,两个氮原子位于体内,所以该晶胞中Fe原子个数为:12×![]() +2×
+2×![]() +3=6,N原子数为2,故该晶体中铁、氮的微粒个数之比为6∶2=3∶1;
+3=6,N原子数为2,故该晶体中铁、氮的微粒个数之比为6∶2=3∶1;
故答案为3∶1;
(6)根据晶胞图可知,氧化亚铁晶胞类似氯化钠晶胞,棱上3个离子相切,晶胞参数等于相邻两个离子核间距的2倍;上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,所以,有12个Fe2+与Fe2+紧邻且等距离;用“均摊法”,1个晶胞中含有Fe2+个数为:6×![]() +8×
+8×![]() =4,含有O2-个数为:12×
=4,含有O2-个数为:12×![]() +1=4,所以1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短间距为apm,根据密度关系:
+1=4,所以1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短间距为apm,根据密度关系:  ,可得到
,可得到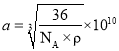 。
。
故答案为12 ,/span> 。
。


科目:高中化学 来源: 题型:
【题目】绿原酸是金银花的主要抗菌、抗病毒有效药理成分之一,其结构如图所示。下列有关说法正确的是( )
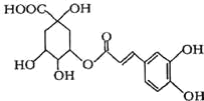
A.分子式为C16H16O9
B.能与碳酸钠溶液反应,但不产生二氧化碳
C.能发生催化氧化反应并生成能发生银镜反应的产物
D.NaOH、H2、溴水分别与1mol绿原酸反应时,消耗反应物的最大物质的量都为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )

A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.仪器a的作用是冷凝回流,提高原料的利用率
C.浓硫酸、浓硝酸和苯混合时,应先向浓硫酸中缓缓加入浓硝酸,待冷却至室温后,再将所得混合物加入苯中
D.反应完全后,可用蒸馏的方法分离苯和硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。
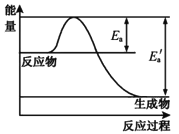
下列说法正确的是( )
A.Ea为逆反应活化能,Ea′为正反应活化能
B.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.该反应为放热反应,ΔH=Ea′-Ea
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
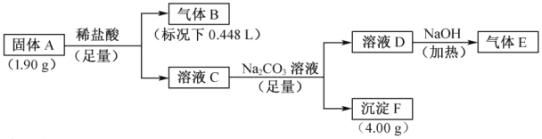
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件可生成乌洛托品(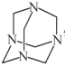 学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如图(部分反应条件和试剂略去):
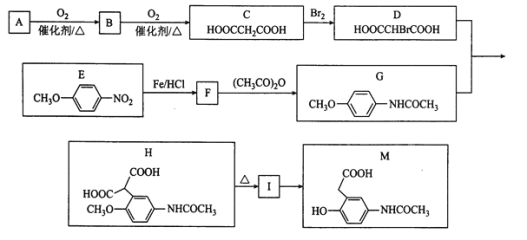
已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②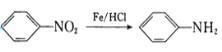 (-NH2容易被氧化);
(-NH2容易被氧化);
③ R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为___;D中官能团的名称为___。
(2)C→D的反应类型是___,I的结构简式为___。
(3)F→G的化学方程式为___。
(4)M不可能发生的反应为___(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有___。
①能与FeCl3溶液发生显色反应②能与NaHCO3反应③含有—NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用下列反应来检查氯气管道是否漏气:3Cl2+8NH3=N2+6NH4Cl,下列说法错误的是
A. 若有白烟产生则管道漏气 B. 该反应中NH4Cl是还原产物
C. 反应中NH3只显还原性 D. 生成1.4gN2时转移0.3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为________。
② 若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2﹣二甲基丁烷,则烃A的名称是_______,结构简式是______。
③比烃A少两个碳原子且能使溴水褪色的A的同系物有__种同分异构体
(2)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是_____。
A. CH3﹣CH3 B. CH3COOH C. CH3COOCH3 D. CH3COCH3
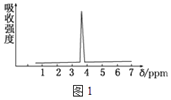
(3)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图1所示,则A的结构简式为_______。
(4)某化合物的结构式(键线式)及球棍模型如图2:该有机分子的核磁共振氢谱图如图3(单位是ppm) 。下列关于该有机物的叙述正确的是_______。

A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香族化合物,且属于酚
C. 键线式中的Et代表的基团为﹣CH3
D. 该有机物在一定条件下能够发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com