
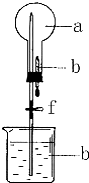
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )| A. | CO2(NaHCO3溶液)无色喷泉 | B. | NH3(H2O含酚酞)红色喷泉 | ||
| C. | Cl2(NaOH溶液)无色喷泉 | D. | HCl(AgNO3溶液)白色喷泉 |
分析 能形成喷泉,圆底烧瓶中的气体应易溶或能烧杯中的液体发生反应,结合选项中对应物质的性质解答.
解答 解:A.因NaHCO3溶液抑制CO2的溶解,则挤压胶管的胶头,气压变化不明显,则不会形成喷泉,故A错误;
B.因氨气极易溶于水,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因氨水溶液显碱性,酚酞遇碱变红,故形成红色喷泉,故B正确;
C.氯气与氢氧化钠反应,可形成喷泉,故C正确;
D.因HCl与AgNO3溶液反应生成白色的AgCl沉淀,则挤压胶管的胶头,使烧瓶中的气压减小,且小于外界大气压,则形成喷泉,又因溶液中有白色的AgCl,溶液变白,故形成白色喷泉,故D正确.
故选A.
点评 本题综合考查元素化合物知识,为高考常见题型,难度大不大,注意把握相关物质的性质以及形成喷泉的条件.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
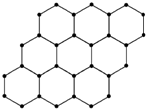
| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的溶解性比NaHCO3小 | |
| B. | SiO2与酸、碱均能反应,属于两性氧化物 | |
| C. | NO2溶于水时发生氧化还原反应 | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 用溴水和CCl4除去NaBr溶液中少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| B | 配制100mL l.0mol•L-1的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
| C | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
| D | 用盐酸除去BaSO4中混有的少量BaCO3 | 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com