
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是_____________。

(2)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 ______________。

(3)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如图二(已知2SO2(g)+O2(g)=2SO3(g) △H=196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图三所示。
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
①曲线c对应NH3与NO的物质的量之比是______。
② 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO
(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO![]() )=________mol·L-1(小数点后两位).
)=________mol·L-1(小数点后两位).
【答案】 D 有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生 < = > < 1:1 3:1 1:3 1.5×10-4 0.02 mol·L-1
【解析】试题分析:(1)某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),说明反应Ⅰ的活化能小于反应Ⅱ;反应Ⅰ吸热、反应Ⅱ放热;(2)若没有二氧化硫,则反应I未发生;若c(CO2)=c(SO2),则反应II未发生;若c(CO2)>c(SO2),则反应同时发生;(3)根据一边倒的原则,甲乙为等效平衡;丙的投料为甲、乙的2倍;(4)根据图示,a点c(HSO3-)、c(H2SO3)相等;b点时溶液c(HSO3-)= c(SO32-),c(H+)= c(OH-),根据电荷守恒,c(HSO3-)+ 2c(SO32-)+ c(OH-)=c(NH4+)+ c(H+);(5)①NH3比例越大,NO转化率越大;②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点NO的转化率由55%到75%,NO浓度变化为1.2×10-4mg/m3;(6)发生反应SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 静置后沉淀转化达到平衡,
(aq) 静置后沉淀转化达到平衡, 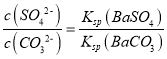 。
。
解析:(1)某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),说明反应Ⅰ的活化能小于反应Ⅱ;反应Ⅰ吸热、反应Ⅱ放热,故选D。(2)若没有二氧化硫,则反应I未发生;若c(CO2)=c(SO2),则反应II未发生;若c(CO2)>c(SO2),则反应同时发生;所以通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生。(3)根据一边倒的原则,丙的投料为甲的2倍,可以假设丙体积为甲的2倍,甲、丙为等效平衡,转化率的和为1,平衡时丙中SO3的物质的量是甲的2倍,平衡后缩小丙的体积与甲相同,丙平衡向生成SO3的方向移动,丙中SO3的转化率减小,转化率的和小于1,即α1+α3<1,丙SO3的浓度大于甲的2倍,即2c1<c3 ;根据一边倒的原则,甲乙为等效平衡,甲由正方向建立平衡,乙由逆方向建立平衡,所以a+b=196.6;丙的投料为乙的2倍,可以假设丙体积为甲的2倍,乙、丙为等效平衡,平衡时丙中气体的物质的量是乙的2倍,平衡后缩小丙的体积与乙相同,丙平衡向生成SO3的方向移动,丙SO3的浓度大于甲的2倍,所以2p2>p3;(4)根据图示,a点c(HSO3-)、c(H2SO3)相等,所以a点时n(HSO3-):n(H2SO3)=1:1;b点时溶液c(HSO3-)= c(SO32-),c(H+)= c(OH-),根据电荷守恒,c(HSO3-)+ 2c(SO32-)+ c(OH-)=c(NH4+)+ c(H+),所以c(NH4+)=3 c(HSO3-),n(NH4+):n(HSO3-)=3:1;(5)①NH3比例越大,NO转化率越大,曲线c对应NH3与NO的物质的量之比是1:3;②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点NO的转化率由55%到75%,NO浓度变化为1.2×10-4mg/m3, ![]() 1.5×10-4 mg/(m3·s); (6)设反应后c(SO
1.5×10-4 mg/(m3·s); (6)设反应后c(SO![]() )=xmol·L-1,则消耗c(SO
)=xmol·L-1,则消耗c(SO![]() )=(0.4-x)mol·L-1,生成c(CO
)=(0.4-x)mol·L-1,生成c(CO![]() )=(0.4-x)mol·L-1;SO
)=(0.4-x)mol·L-1;SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 静置后沉淀转化达到平衡,
(aq) 静置后沉淀转化达到平衡, ![]() ,解得x=0.02 mol·L-1。
,解得x=0.02 mol·L-1。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如下图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
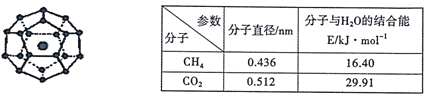
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为_______;碳原子的最高能级的符号是_______,其电子云形状是_______。
(2)CO2分子中碳原子的杂化轨道类型为_______,分子的立体构型为_____。CO2与SO2相同条件下在水中的溶解度较大的是SO2,理由是________。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_______。
(4)“可燃冰”中分子间存在的作用力是氢键和_________,上图中最小的环中连接的原子总数是_______。
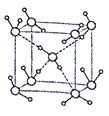
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5 倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H…O距离为apm,阿伏加德罗常数的值为NA,则该冰- Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的锥形瓶内充满干燥气体X,滴管内盛有液体Y,将滴管内的液体挤压到锥形瓶中,轻轻振荡,一会儿可见小气球a鼓涨,下列X和Y的组合不可能的是( )
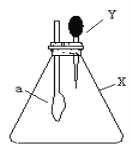
X | Y | |
A | HCl | 饱和食盐水 |
B | H2 | 浓硫酸 |
C | HCl | 2mol/L NaOH溶液 |
D | Cl2 | 6mol/L NaOH 溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是“聚宝盆”,工业上,人们直接从海水中得到食盐。海水在浓缩过程中析出盐类物质的种类和质量,如下表:
海水密度(g/L) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.13 | 0.56 | ||||
1.20 | 0.91 | ||||
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)常采用____________的方法从海水中得到食盐。
(2)为得到含杂质较少的食盐,实际生产中卤水的密度控制在_____之间。
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,通常在实验室中依次加入_________、__________、___________、___________等四种物质除去杂质。(填化学式)
(4)电解饱和食盐水可以制取氯气,同时得到几种重要的化工产品,
该反应的化学方程式为_________________________________________。通电时阳极产物是__________该产物的检验方法是___________________________________________
(5)电解过程中得到气体物质还可以化合为HCl,在实验室中我们利用_________________和_____________ 反应(写名称)来制取。该气体__________________溶于水,可以做喷泉实验。写出氯化氢气体溶于水后的电离方程式_____________________________________
(6)新制的氯水显_______色,这是因为氯水中有__________(填微粒符号)存在。向氯水中滴入几滴AgNO3溶液,观察到的现象是____________________________,发生变化的化学方程式为______________________________________________。蓝色石蕊试纸遇到氯水后的现象是___________________________,氯气有毒,不能直接排放到空气中,需要用________________________来吸收,写出反应的化学方程式为_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。
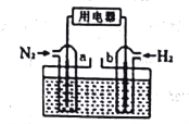
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是( )
A.用蒸馏的方法制取蒸馏水
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
A.用浓硫酸干燥NH3B.用Cu与稀硝酸反应制取少量NO
C.用KMnO4酸性溶液鉴别SO2与CH2=CH2D.用铜粉除去CuCl2溶液中少量FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷有两种二氯代物
B. 甲苯能使酸性高锰酸钾溶液褪色,体现了甲基对苯环的影响
C. 甲烷与乙烯可以通过燃烧的方法加以区分
D. 煤中含有苯和甲苯,通过干馏、分馏可以分离得到苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. s能级的能量一定比p能级低 B. 电子云图中小黑点多的区域表示电子多
C. 3p2表示第三能层上有两个电子 D. 同一原子中,2p、3p、4p能级的轨道数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com