
| A. | 晶体硅硬度大、熔点高,因而可用于制作半导体材料 | |
| B. | 常温下铝制品可以储运浓硫酸和浓硝酸 | |
| C. | 水煤气、液氯、水玻璃、福尔马林为混合物 | |
| D. | 金属汞一旦洒落在实验室地面或桌面上,必须尽快收集,并深埋处理 |
分析 A.Si为原子晶体,且Si位于金属与非金属的交界处,具有一定的金属性和非金属性;
B.常温下,Al遇浓硫酸、浓硝酸发生钝化;
C.液氯为纯净物;
D.Hg为重金属,深埋会污染土壤.
解答 解:A.Si为原子晶体,则晶体硅硬度大、熔点高;且Si位于金属与非金属的交界处,具有一定的金属性和非金属性,则Si可用于制作半导体材料,因果关系不合理,故A错误;
B.常温下,Al遇浓硫酸、浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则常温下铝制品可以储运浓硫酸和浓硝酸,故B正确;
C.液氯为纯净物,而水煤气(CO和氢气)、水玻璃(硅酸钠溶液)、福尔马林(HCHO的水溶液)为混合物,故C错误;
D.Hg为重金属,深埋会污染土壤,则金属汞一旦洒落在实验室地面或桌面上,必须尽快撒硫磺粉收集,故D错误;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10b-5a)mol•L- | B. | (2b-a)mol•L- | C. | ($\frac{b}{10}$-$\frac{a}{20}$)mol•L- | D. | (5b-$\frac{5a}{2}$)mol•L- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 广告称“某品牌的八宝粥(含桂圆、红豆、糯米)不加糖,比加糖还甜,适合糖尿病人食用.”这个广告有误导喜爱甜食消费者的嫌疑,因为不加糖不等于没有糖,糖尿病人食用需慎重 | |
| B. | 用食用醋除去热水瓶中积存的水垢 | |
| C. | 用灼烧闻气味的方法区分化纤织物与纯毛织物 | |
| D. | 用米汤检验加碘盐中的碘酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
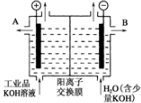
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com