
【题目】天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______。
②有利于提高混合气中CH4含量的措施是:_______。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是_______极(填“正”或“负”)。
②a极的电极反应式是_______________。
【答案】CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-165kJ/mol c 正 CH4-8e-+2H2O=CO2+8H+
【解析】
(1)①CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,①
②CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol②
根据盖斯定律,①-②可得CO2(g) +4H2(g)= CH4(g) +2H2O(g),据此计算出△H;
②提高混合气中CH4含量,需要使平衡向着正向移动,据此该反应为放热反应,结合温度、浓度等对化学平衡影响分析;
(2)甲烷燃料电池中,通入燃料甲烷的电极为失去电子,发生氧化反应,为原电池的负极,通入氧气的电极获得电子,发生还原反应,为原电池的正极,据此进行解答。
(1)①CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol;①
CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol;②
根据盖斯定律,①-②可得CO2(g) +4H2(g)![]() CH4(g) +2H2O(g),△H=(-206kJ/mol)-(-41kJ/mol)=-165kJ/mol;
CH4(g) +2H2O(g),△H=(-206kJ/mol)-(-41kJ/mol)=-165kJ/mol;
②a.使用催化剂,对化学平衡无影响,无法提高混合气中CH4含量,a错误;
b.CO2(g) +4H2(g)![]() CH4(g) +2H2O(g) △H=-165kJ/mol的正反应为放热反应,升高温度,化学平衡向着吸热的逆反应方向移动,使甲烷的含量减小,b错误;
CH4(g) +2H2O(g) △H=-165kJ/mol的正反应为放热反应,升高温度,化学平衡向着吸热的逆反应方向移动,使甲烷的含量减小,b错误;
c.及时导出水蒸气,减少了生成物浓度,化学平衡向着正反应方向移动,可提高混合气中CH4含量,c正确;
故合理选项是c;
(2)①电极b通入的是O2,O2在反应中得到电子发生还原反应,则电极b为该原电池的正极;②a通入的是甲烷,甲烷失去电子被氧化成CO2,该电极反应式为:CH4-8e-+2H2O=CO2+8H+。


科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )

A. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. 在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③增大装置的压强 ④装置中放入碱石灰
A. ①③④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
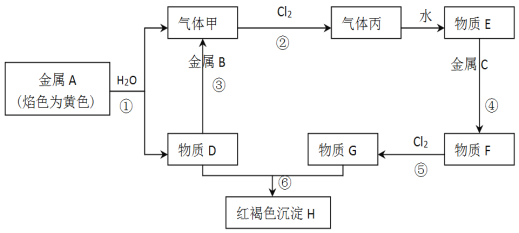
①金属C的名称_______
②气体丙的分子式___________
③写出下列反应的化学方程式:反应①___________________________;反应⑥________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.5 g锌放入足量的稀硫酸中充分反应,得到80 mL密度为1.25 g/mL的溶液。试计算回答:
①所得溶液中硫酸锌的物质的量浓度为________,质量分数为____。
②生成的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中HCO3―、CO32―、H2CO3 三种微粒的浓度由大到小的顺序为:_______________________________。
(2)NaHCO3溶液与硫酸铝溶液混合的离子方程式_______________________________。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物(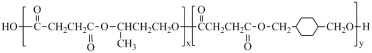 )是良好的生物可降解材料,其合成路线如下:
)是良好的生物可降解材料,其合成路线如下:

已知: (R,R’,R’’代表烷基或H)
(R,R’,R’’代表烷基或H)
(1)已知A的核磁共振氢谱有二个峰,A的结构简式是_______。
(2)B可使澄清的苯酚钠水溶液变浑浊,B中的含氧官能团名称是________。
(3)B与试剂a在一定条件下反应生成C的化学方程式是________。
(4)D转化为E的化学方程式是________。
(5)F的结构简式是________。
(6)由G生成H的化学方程式是________。
(7)聚合物P具有较好的可降解性,其原因是_________。
(8)以1,3-丁二烯为原料(无机试剂任选),设计J的合成路线________。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯在医药工业中可作为有机合成的中间体,其中一种合成路线如下:
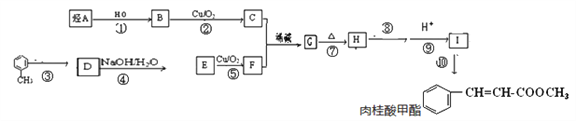
已知:①烃A是最简单的烯烃
②醛与醛能在一定条件下反应,原理如下:
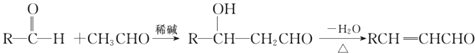
回答下列问题:
(1)烃A的结构简式为____________。
(2)反应③的试剂和反应条件为___________;反应⑩的试剂和反应条件为______________;反应⑧的反应试剂______________(填“能”或“不能”)改用酸性高锰酸钾溶液,其原因是___________________。
(3)反应⑦的反应类型为______。
(4)H与银氨溶液反应的化学方程式为______________________。
(5)符合下列条件的I的同分异构体共有______种。
①除苯环外不含有其他环状结构;②能发生水解反应和银镜反应。
其中核磁共振氢谱显示为5组峰,且峰面积比为1:1:2:2:2的是______(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作
![]()
则甲、乙、丙三种溶液中溶质可能是
A.BaCl2、H2SO4、MgCl2 B.CaCl2、HNO3、AgNO3
C.CaCl2、HNO3、NaCl D.BaCl2、HCl、NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com