
分析 (1)常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应;绝大多数化合反应、置换反应;少数分解、复分解反应.
常见的吸热反应有:个别的化合反应(如C和CO2),绝大数分解反应、少数置换以及某些复分解(如铵盐和强碱);
(2)依据中和热的概念是强酸强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应反应焓变得到;
(3)由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,并注意物质的状态来解答;
(4)根据金刚石和石墨燃烧的热化学方程式,利用盖斯定律可求金刚石转化为石墨的热化学方程式;能量越低越稳定,据此进行解答.
解答 解:(1)a.Ba(OH)2•8H2O与NH4Cl的反应为吸热反应,故a错误;
b.高温煅烧石灰石是分解反应,为吸热反应,故b错误;
c.铝与盐酸的反应为放热反应,故c正确;
故选c;
(2)1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,H2SO4与NaOH反应的中和热的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1;
(3)①由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,
则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1;
(4)①C(S,金刚石)+O2(g)=CO2(g)△H=-395.41KJ/mol,
②C(S,石墨)+O2(g)=CO2(g)△H=-393.51KJ/mol,
利用盖斯定律将①-②可得:C(s,金刚石)=C(s,石墨),△H=(-395.41kJ•mol-1)-(-393.51kJ•mol-1)=-1.9kJ•mol-1,金刚石转化为石墨放热,说明石墨能量更低,更稳定,
故答案为:C(s,金刚石)=C(s,石墨)△H=-1.9kJ•mol-1;石墨.
点评 本题考查了应用盖斯定律求反应热,物质的稳定性与能量的关系,利用盖斯定律求反应热关键熟悉已知热化学方程式与目标方程式的关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| D. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
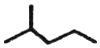 ②甲苯 ③ClCH=CHCl ④
②甲苯 ③ClCH=CHCl ④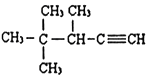
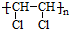
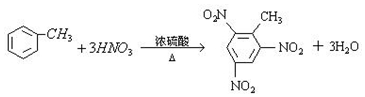 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 硼原子以sp3杂化 | |
| C. | 氯化硼分子属极性分子 | |
| D. | 氯化硼遇水蒸气会产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
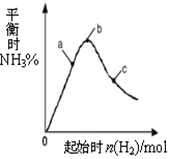 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 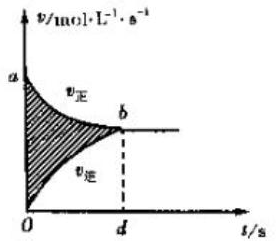 图阴影部分面积表示反应物浓度的净减少量M | |
| B. | 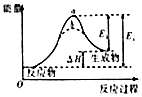 图虚线b表示反应加入催化剂后能量变化曲线 | |
| C. | 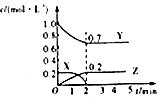 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)?2Z(g) | |
| D. |  图对应于反应H2(g)+CO2(g)?H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的$\frac{2}{3}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com