
| A. | $\frac{125a}{9V}$mol/L | B. | $\frac{125a}{18V}$mol/L | C. | $\frac{125a}{36V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
分析 根据n=$\frac{m}{M}$计算agAl3+的物质的量,再根据V/4ml溶液中含有的Al3+的物质的量结合化学式可知n(SO42-)=$\frac{3}{2}$n(Al3+),再根据c=$\frac{n}{V}$计算稀释后溶液中硫酸根离子的浓度.
解答 解:agAl3+的物质的量为:$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,
取出的$\frac{V}{4}$ml溶液中含有Al3+的物质的量为:$\frac{1}{4}$×$\frac{a}{27}$mol,
根据硫酸铝的化学式可知,取出的溶液中含有硫酸根离子的物质的量为:n(SO42-)=$\frac{3}{2}$n(Al3+)=$\frac{1}{4}$×$\frac{a}{27}$mol×$\frac{3}{2}$=$\frac{a}{72}$mol,
所以稀释为4VmL后溶液中硫酸根离子浓度为:c(SO42-)=$\frac{\frac{a}{72}mol}{4V×1{0}^{-3}L}$=$\frac{125a}{36V}$mol/L,
故选C.
点评 考查物质的量浓度的有关计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确溶质的化学式与各离子之间量的关系,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 汽车排放的尾气中含有NO、CO2等大气污染物 | |
| D. | 安装煤炭“固硫”装置,可以降低酸雨发生率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
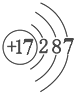
| A. | X属于金属元素 | B. | 该原子的核外电子数为7 | ||
| C. | X与Na形成的化合物为NaX | D. | 该原子最外电子层达到了稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
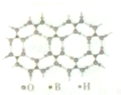 元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点
元素周期表可以指导我们寻找和合成成新的物质,如金属和非金属分界线附近的元素可用于制造半导体材料,是科学研究的热点 或
或 ,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)
,硼酸具有层状结构,每层结构如图所示,每摩尔晶体中所含氢键的数目为3NA(设NA为阿伏伽德罗常数的值)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丙<丁<乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 甲,乙,丙的氧化物均为共价化和物 | |
| D. | 乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com