
| A、铁易生锈,而铝在空气中较稳定,所以铁比铝活泼 |
| B、铝能在空气中稳定存在是因为其表面覆盖着一层保护膜 |
| C、氧化铝是一种难溶物质,是一种较好的耐火材料 |
| D、氢氧化铝能中和胃酸,可用于制胃药 |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、11.2L O3气体中含有的氧原子数是1.5NA |
| B、含12.0g NaHSO4的水溶液中钠离子数为0.1NA |
| C、1mol OH-中电子数为10NA |
| D、每有1mol Cl2反应转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移4NA个电子 |
| B、常温常压下,33.6L Cl2与56g Fe充分反应,转移电子数为3NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、在1L 0.2mol?L-1的硫酸铁溶液中含有的铁离子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ |
| C、①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-=BaSO4↓+H2O |
| B、少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、硫氢化钠发生水解:HS-+H2O?H3O++S2- |
| D、FeS固体加入到用硫酸酸化的H2O2溶液中:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、金属的晶胞如图所示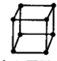 ,其配位数为8 ,其配位数为8 | ||||||||
| B、SO2分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为sp3杂化,是直线型分子 | ||||||||
| C、醋酸钠溶液中离子浓度的关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||||||||
D、已知反应2CH3OH(g)?CH3OCH3+H2O(g),某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量CH3OH,某时刻测得各组分浓度如下表,则此时正、逆反应速率的大小关系为:v正>v逆
|
查看答案和解析>>
科目:高中化学 来源: 题型:
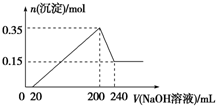 将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )| A、镁和铝的总质量为9g |
| B、合金与稀硫酸反应生成的氢气体积为10.08L |
| C、稀硫酸的物质的量浓度为2.5mol/L |
| D、氢氧化钠溶液的物质的量浓度为5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com