
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.分析 (1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)A中电解氯化钾得到氢氧化钾溶液,B中电解硫酸铜溶液生成硫酸,pH减小,根据C中电极反应判断;
(3)根据电极反应及电子守恒来计算;
(4)根据A中的电极反应及与C中转移的电子守恒来计算.
解答 解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,故答案为:负;
(2)A中电解氯化钾得到氢氧化钾溶液,pH增大,B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,
故答案为:增大;减小;不变;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案为:0.025mol/L;
(4)由A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,溶液pH=13,
故答案为:13.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.015 | 0.012 | 0.010 | 0.010 | 0.010 |
| A. | 在0~2s内,v(O2)=0.002mol•L-1•s-1 | |
| B. | 5s后向容器中通入0.02mol NO2,再次平衡后,0.020mol<n(NO2)<0.040 mol | |
| C. | 在该温度时,向容器中加入O2,平衡将正向移动,平衡常数增大 | |
| D. | 5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,平衡向正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有PCl5 | B. | 只有PCl3 | ||
| C. | 只有Cl2 | D. | 以上三种物质都有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
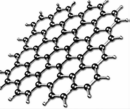 | 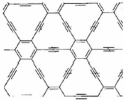 |  |
| 石墨烯:从石墨中分离出来,是最薄、最坚硬的物质 | 石墨块:平面网状结构的全碳分子,具有优良的化学稳定性 | 纳米碳管:具有优良的场发射性能,制作阴极显像管、储氢材料 |
| A. | 石墨烯具有良好的导电性 | |
| B. | 上述三种物质与金刚石互为同素异形体 | |
| C. | 石墨炔孔径略大于H2分子的直径,可作H2的提纯薄膜 | |
| D. | 上述三种物质与浓硫酸都能发生反应,但反应产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 滴定管装液滴定时应先用标准溶液润洗 | |
| C. | 蒸馏时温度计的水银球处于蒸馏烧瓶支管附近 | |
| D. | 锥形瓶用作反应容器时,一定不能加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{135}{53}$I是碘的一种同素异形体 | |
| B. | $\stackrel{135}{53}$I是一种新发现的元素 | |
| C. | $\stackrel{135}{53}$I位于元素周期表中第四周期ⅦA族 | |
| D. | $\stackrel{135}{53}$I核内的中子数与核外电子数之差为29 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com