
【题目】VA族元素氮、磷、砷(As)、锑(Sb)、铋(Bi)的单质及其化合物在科研和生产中有许多重要用途。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的价电子排布式为_______。
(2)第三周期元素中第一电离能大于磷的元素有_______(填元素符号)。
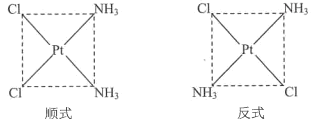
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是_______(填“顺式”或“反式”)。
(4)氨硼烷(BH3NH3)是一种储氢材料,与乙烷互为等电子体,熔点为104℃。氨硼烷晶体中各种微粒间的作用力涉及________(填标号)。
A.范德华力 B.离子键 C.配位键 D.金属键
(5)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,可杀死各种草本植物,其阴离子的立体构型为___。
(6)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H44+,其结构式为_______,其中N原子的杂化方式为________。
(7)镧、铁、锑三种元素组成的一种固体能实现热电效应。该固体晶胞结构如图l所示,晶胞参数为a nm,Fe原子填在6个Sb原子形成的正八面体空隙中,晶胞6个表面的结构都如图2所示。
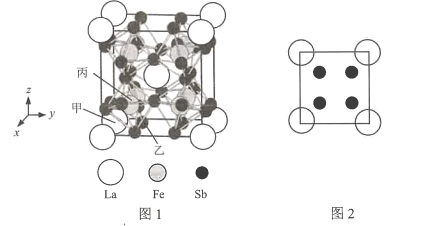
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图l中原子甲的坐标为(0,0,0),原子乙的坐标为(![]() ,
,![]() ,0),则原子丙的坐标为________。
,0),则原子丙的坐标为________。
②设阿伏加德罗常数的值为NA,则该固体的密度ρ=__g·cm-3(列出计算式即可)。
【答案】6s26p3 Ar、Cl 反式 AC V形(或角形、折线形) 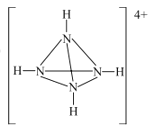 sp3 (
sp3 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)第VA的元素最外层有5个电子,根据构造原理可得其价层电子排布式;
(2)根据同一周期的元素,原子序数越大,元素的电离能越大分析(第IIA、VIA反常);
(3)H2O是由极性分子构成的物质,根据相似相溶原理分析;
(4)氨硼烷属于分子晶体,根据分子内元素的原子结构特点及分子之间的作用力分析;
(5)根据价层电子对数及孤电子对数分析判断;
(6)根据N4H44+具有正四面体结构,结合N、H原子个数比书写其结构式;根据该微粒中N原子结合其它原子数目确定其杂化轨道类型;
(7)①根据图示可知丙原子在体对角线的![]() 处,根据已知原子的坐标可确定丙原子的坐标;
处,根据已知原子的坐标可确定丙原子的坐标;
②利用均摊方法计算一个晶胞中含有的各种元素的原子个数,然后根据密度ρ=![]() 计算。
计算。
(1)铋是第六周期第VA的元素,价电子排布式为6s26p3;
(2)一般情况下同一周期的元素,原子序数越大,元素的第一电离能也越大,但第VA的元素由于其处于p轨道的半充满的稳定状态,其第一电离能大于同周期相邻元素,第一电离能P>S,故第三周期元素中第一电离能大于磷的元素有Cl、Ar;
(3)H2O是由极性分子构成的物质,根据相似相溶原理:由极性分子构成的溶质易溶于由极性分子构成的溶剂中。由图示可知Pt(NH3)2C12的顺式结构的极性大于反式结构的极性,所以它在水中溶解度:顺式大于反式,即反式的Pt(NH3)2C12在水中溶解度比较小;
(4)氨硼烷属于分子晶体,分子之间以范德华力结合,在分子内N、H原子间及B、H原子间以共价键结合,B、N原子之间以配位键结合,其中N提供孤对电子,B原子提供空轨道,故合理选项是AC;
(5)偏亚砷酸钠(NaAsO2)的阴离子是AsO2-,其中As原子的孤电子对数为![]() =1,价层电子对数为1+2=3,所以As原子采用sp2杂化,所以AsO2-的立体构型为V形;
=1,价层电子对数为1+2=3,所以As原子采用sp2杂化,所以AsO2-的立体构型为V形;
(6)N4H44+具有正四面体结构,由于N、H原子个数比是1:1,则其结构式为 ;根据微粒结构可知N原子最外层的1个s轨道和3个p轨道全部参与成键,形成了四个共价键,故其杂化轨道类型为sp3杂化;
;根据微粒结构可知N原子最外层的1个s轨道和3个p轨道全部参与成键,形成了四个共价键,故其杂化轨道类型为sp3杂化;
(7)①根据图示可知:丙原子在体对角线的![]() 处,由于甲原子坐标为(0,0,0),乙原子坐标为(
处,由于甲原子坐标为(0,0,0),乙原子坐标为(![]() ,
,![]() ,0)可知丙原子的坐标为(
,0)可知丙原子的坐标为(![]() ,
,![]() ,
,![]() );
);
②根据晶胞结构可知,在一个晶胞中含有的La:8×![]() +1=2;含有Fe:8×1=8;含Sb:24×
+1=2;含有Fe:8×1=8;含Sb:24×![]() +(3×8)×
+(3×8)×![]() =24,晶胞边长L=a nm=a×10-7 cm,所以该固体的密度ρ=
=24,晶胞边长L=a nm=a×10-7 cm,所以该固体的密度ρ=![]() =
=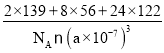 g/cm3=
g/cm3=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】如图为超氧化钾(KO2)晶体的一个晶胞,则下列有关说法正确的是( )
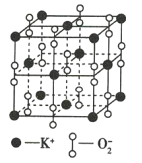
A.KO2中只存在离子键
B.每个晶胞中含有1个K+和1个O2-
C.晶体中与每个K+距离最近且相等的O2-有6个
D.晶体中所有原子之间都以离子键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高聚物![]() 是一种工业增塑剂,其合成路线如图所示:
是一种工业增塑剂,其合成路线如图所示:
![]()
已知![]() 的苯环上只有一个侧链,且侧链上有两种不同化学环境的氢原子;
的苯环上只有一个侧链,且侧链上有两种不同化学环境的氢原子;![]() 是芳香烃。回答下列问题:
是芳香烃。回答下列问题:
(1)![]() 中含氧官能团的名称为__________,
中含氧官能团的名称为__________,![]() 的分子式为________,
的分子式为________,![]() 的反应条件为________,
的反应条件为________,![]() 的结构简式为_________________。
的结构简式为_________________。
(2)![]() 是与
是与![]() 含有相同官能团的同分异构体,相同条件下也能制得
含有相同官能团的同分异构体,相同条件下也能制得![]() ,写出由
,写出由![]() 生成
生成![]() 的化学方程式:_______。
的化学方程式:_______。
(3)写出![]() 的化学方程式:_______。
的化学方程式:_______。
(4)![]() 的消去产物
的消去产物![]() 是一种药物中间体,下列关于
是一种药物中间体,下列关于![]() 的叙述正确的是________(填序号)。
的叙述正确的是________(填序号)。
a.能发生取代、消去、氧化、加聚反应
b.等物质的量的![]() 与
与![]() 混合,在一定条件下发生酯化反应,生成物可能的分子式为
混合,在一定条件下发生酯化反应,生成物可能的分子式为![]()
c.1molH在一定条件下与![]() 反应,最多消耗
反应,最多消耗![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列8种物质:①甲烷,②苯,③聚乙烯,④二氧化硫,⑤2-丁炔,⑥环己烷,⑦环已烯,⑧对二甲苯。其中既能使酸性![]() 溶液褪色又能与溴水反应使之褪色的是( )
溶液褪色又能与溴水反应使之褪色的是( )
A.③④⑤⑧B.④⑤⑦⑧C.③④⑤⑦⑧D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验溴乙烷中的溴原子 | 加入 |
B | 检验溴乙烷发生了消去反应 | 加 |
C | 除去溴苯中的溴 | 用 |
D | 确定乙醇分子的结构 | 通过质谱仪进行质谱分析 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与氢键有关的是( )
①NH3的沸点比PH3的高
②乙醇能与水以任意比混溶,而甲醚(![]() )难溶于水
)难溶于水
③邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低
④水分子在高温下很稳定
A.①②③B.①②④C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素,氮是空气中含量最多的元素。
(1)![]() 中的O-H键、分子间的范德华力和氢键由强到弱的顺序依次为__________>__________>__________。
中的O-H键、分子间的范德华力和氢键由强到弱的顺序依次为__________>__________>__________。
(2)![]() 的沸点高于
的沸点高于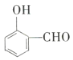 ,其原因是____________________。
,其原因是____________________。
(3)N、P、As都属于第ⅤA族元素,形成简单氢化物的沸点由高到低的顺序为__________(填分子式,下同)>__________>__________。
(4)如图1表示某种含氮有机化合物的结构简式,其分子内4个氮原子分别位于正四面体的4个顶点(见图2)。分子内存在空腔,能嵌入某种离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是__________(填标号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
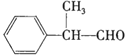
【题目】有机化学反应因反应条件不同,可生成不同的有机产品。例如:
 (X为卤素原子)
(X为卤素原子)
苯的同系物与卤素单质混合,若在光照条件下,则苯环侧链上的氢原子被卤素原子取代;若在催化剂作用下,则苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成一种香料:
![]() A
A![]() B(一氯代物)
B(一氯代物)![]() C
C![]() D
D![]() E
E ![]()
 (香料)
(香料)
已知A的核磁共振氢谱上有5组峰,且峰面积之比为![]() 。请回答下列问题。
。请回答下列问题。
(1)A的结构简式为____________,E的结构简式为_____________。
(2)反应①的反应类型为_______,物质C中的官能团名称是________。
(3)反应③的反应条件是_______。
(4)反应④的化学方程式为_________(注明反应条件)。
(5)这种香料具有多种同分异构体,写出符合下列条件的同分异构体可能的结构简式:___________。
①含有酚羟基 ②分子中有苯环,且苯环上的一溴代物有两种 ③在一定条件下,自身能形成高聚物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是主要的炼铜原料, CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是_________。下列基态原子或离子的价层轨道表示式正确的是_______(填标号)。
a.Fe2+:![]() b.Cu:
b.Cu:![]()
c.Fe3+:![]() d.Cu+:
d.Cu+:![]()
(2)在较低温度下 CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是________,中心原子杂化类型为______,属于________(填“非极性”或“极性”)分子。
②X的沸点比水低的主要原因是________。
(3)CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为_____,共价键的类型有________。
(4)四方晶系CuFeS2的晶胞结构如图所示。
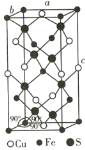
①Cu+的配位数为________,S2-的配位数为________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________g·cm-3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com