
| A. | c(H+)+c(Na+)>c(CO32-)+c(HCO3-)+c(OH-) | B. | c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) | ||
| C. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
分析 碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,但其水解程度较小,溶液中存在电荷守恒及物料守恒,根据电荷守恒及物料守恒判断.
解答 解:A.根据电荷守恒得c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-),所以得c(H+)+c(Na+)>c(CO32-)+c(HCO3-)+c(OH-),故A正确;
B.溶液中存在质子守恒,根据质子守恒的c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-),故B正确;
C.溶液中存在物料守恒,根据物料守恒得c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故C错误;
D.碳酸根离子水解导致溶液呈碱性,钠离子不水解,则c(Na+)>c(CO32-),碳酸根离子水解、碳酸氢根离子水解及水电离都生成氢氧根离子,只有碳酸根离子水解生成碳酸氢根离子,所以c(OH-)>c(HCO3-),碳酸氢根离子浓度接近氢氧根离子浓度,溶液呈碱性,则c(OH-)>c(H+),所以c(HCO3-)>c(H+),则离子浓度大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶质的性质及溶液酸碱性是解本题关键,侧重考查学生分析判断及知识灵活运用能力,难点是判断D中c(HCO3-)、c(H+)相对大小,题目难度中等.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:实验题
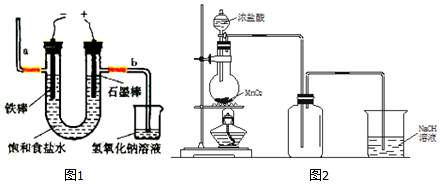
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过电泳实验证明胶体带电 | |
| B. | 通常利用丁达尔效应区别溶液与胶体 | |
| C. | 过滤实验说明胶体粒子不能透过滤纸 | |
| D. | 向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
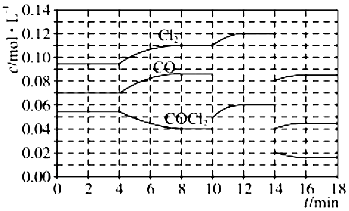 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
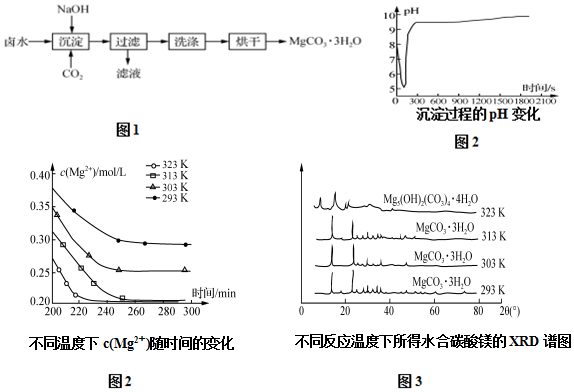
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Fe2+与NO3-在酸性溶液中的反应:Fe2++NO3-+4H+=Fe3++NO↑+2H2O | |
| C. | 稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐--③④ | B. | 纯净物--④⑤⑥ | C. | 碱--④⑤ | D. | 混合物--②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
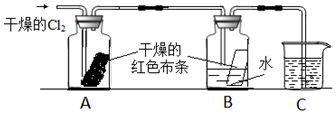
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com