
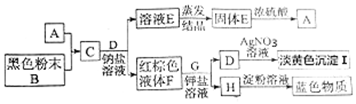
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.分析 A和黑色粉末反应生成C,C和钠盐溶液反应生成溶液E和红棕色液体F,溶液E蒸发结晶得到固体E,E溶于浓硫酸得到A,F和钾盐溶液反应生成D和H,D和硝酸银反应生成淡黄色沉淀I,I为AgBr,则F为Br2,H遇淀粉试液变蓝色,则H为I2,根据元素守恒知,D为KBr,E为钠盐,根据已知条件知,E为NaCl,A为HCl;
C和钠盐溶液反应生成NaCl和溴,根据元素守恒知,C为Cl2,浓盐酸和二氧化锰反应生成氯气,则B为MnO2,再结合题目分析解答.
解答 解:(1)通过以上分析知,A~I化学式分别为HCl、MnO2、Cl2、KBr、NaCl、Br2、KI、I2、AgBr,
故答案为:HCl;MnO2;Cl2;NaCl;Br2;KI;I2;AgBr;
(2)反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,转移电子数为2e-,表示电子转移数目与方向为: ,该反应中的氧化剂是二氧化锰,
,该反应中的氧化剂是二氧化锰,
故答案为: ;二氧化锰;
;二氧化锰;
(3)Cl2、Br2、I2三种物质的氧化性由强到弱的顺序为Cl2、Br2、I2,在如图中,能说明该结论有关反应的化学方程式为Cl2+2NaBr=Br2+2NaCl、Br2+2KI=I2+2KBr,
故答案为:Cl2、Br2、I2;Cl2+2NaBr=Br2+2NaCl、Br2+2KI=I2+2KBr;
(4)NaCl和浓硫酸的反应中没有元素化合价变化,即没有电子转移,所以不是氧化还原反应,
故答案为:不是;没有电子转移.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,明确物质的特殊颜色、特殊性质及物质之间的转化是解本题关键,注意题给信息的灵活运用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等. D.相同压强时,NH3沸点比PH3高
D.相同压强时,NH3沸点比PH3高查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 2:3 | C. | 1:4 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Fe>Cu | D. | 氧化性:CuCl2>FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
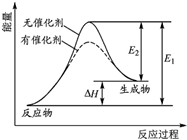 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能改变反应的路径,降低反应所需的活化能 | |
| D. | △H=E1+E2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com