
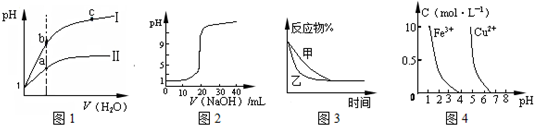
| A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.图2表示0.1000mol?L-1CH3COOH溶液滴定20.00mL0.1000mol?L-1NaOH溶液所得到的滴定曲线 |
| C.图3表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入HCl | B.加少量NaOH固体 |
| C.加水 | D.升温 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶于水的强电解质,在水溶液中全部电离成离子 |
| B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |
| C.某物质若不是电解质,就一定是非电解质 |
| D.难溶于水的电解质一定是弱电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.中和时所需NaOH的量 | B.c(H+) |
| C.c(OH-) | D.c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液作导电试验,灯光较暗 |
| B.HNO2是共价化合物 |
| C.亚硝酸不与氯化钠反应 |
| D.常温下0.1mol?L-1亚硝酸溶液的c(H+)为7.1×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaSO4溶于水的部分能够电离,所以BaSO4是电解质 |
| B.SO2的水溶液能够导电,所以SO2是电解质 |
| C.液态Cl2不导电,所以Cl2是非电解质 |
| D.液态HCl不导电,所以HCl是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com