
在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g)  2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )
2SO3(g) △H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确是( )
A.生成 2 mol SO3 B.放出热量197 kJ
C.SO2 和 SO3 共有 2 mol D.含有氧原子共有3mol
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:选择题
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是( )
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是( )
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
下列化学方程式中,正确的是( )
A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.3 kJ·mol-1
B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H =-2a kJ·mol-1
2NH3(g) △H =-2a kJ·mol-1
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l) =2H2(g)+O2(g) △H =+571.6 kJ·mol-1
D.HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量为57.3kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是 ( )
A.N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.N2(g)+O2(g) 2NO(g) ΔH<0
2NO(g) ΔH<0
C.C(s)+2H2O(g) CO2(g)+2H2(g) ΔH>0
CO2(g)+2H2(g) ΔH>0
D.2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
①原电池是把化学能转化成电能的一种装置 ②原电池的正极发生氧化反应,负极发生还原反应 ③不能自发进行的氧化还原反应,通过原电池的装置均可实现 ④碳棒不能用来作原电池的正极 ⑤反应Cu+ 2Ag+=2Ag+Cu2+,能以原电池的形式来实现
2Ag+=2Ag+Cu2+,能以原电池的形式来实现
A.①⑤ B.①④⑤ C.②③④ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
有a、b、c、d四种金属,将a与b用导线连接起来,浸入电解质溶液中,b不易腐蚀;将a、d分别投入等浓度盐酸中,d比a反应激烈;将铜浸入b的盐溶液中,无明显变化;若将铜浸入c的盐溶液中,有金属c析出,据此判断它们的活动性由强到弱的顺序是( )
A.d>c>a>b B.d>a>b>c
C.d>b>a>c D.b>a>d>c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
已知 25 ℃时部分弱电解质的电离平衡常数数据如下表:

回答下列问题:
(1)写出碳酸的主要的电离方程式 。若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+) 原来的十分之一(填“大于”、“小于”或“等于”).
(2))物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为 (用编号填写)。
a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN
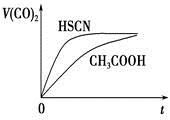
(3)25℃时,将 20mL0.1mol·L-1CH COOH 溶液和 20mL0.1mol·L-1HSCN 溶液分别与 20mL0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图。反应初始阶段两种溶液产生 CO2 气体的速率存在明显差异的原因是 反应结束后,假设 NaHCO3 完全反应且气体全部逸出,则所得两溶液中,c(CH3COO-) _c(SCN-)(填“>”、“<”或“=”;)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)―c(CH3COO-)=_ mol/L(填代入数据后的计算式,不必算出具体数值)。
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为 __________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
常温下,将 pH=3 的硫酸与 pH=9 的 NaOH 溶液混合,若要得到 pH = 7 的溶液,混合时硫酸与 NaOH 溶液的体积比为( )
A.1: 200 B. 200 : 1 C. 100 : 1 D.1:100
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市高三上学期一检化学试卷(解析版) 题型:简答题
工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸,焙烧后的矿渣用于炼铁。其转化过程如下图所示(部分条件、反应物和产物已略去):
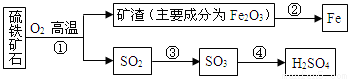
请回答下列问题:
(1)在上面转化过程中,硫元素被氧化的反应是________(填反应编号)。
(2)写出反应②中炼铁的化学方程式_____________。若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为_____________ t.
(3)写出反应①的化学方程式 ,若有12.0g FeS2参加反应,则发生转移的电子数为 。
(4)烟气中SO2的排放会造成酸雨,工业上常用Na2SO3溶液来吸收SO2以减少对环境的危害。
①常温下,将SO2通入一定体积的1.0mol·L-1Na2SO3溶液中,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,此时溶液中c(SO32-)的浓度是0.2mol·L-1,则溶液中c(HSO3-)是 mol·L-1。用化学平衡原理解释此时溶液显酸性的原因 。
②向①中pH约为6时的吸收液中通入足量O2充分反应。取反应后溶液10mL与10mLBaCl2溶液混合,欲使混合时能生成沉淀,所用BaCl2溶液的浓度不得低于 mol·L-1。[已知25℃时,Ksp(BaSO3)=5.48×10-7 , Ksp(BaSO4)= 1.08×10-10]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com