
分析 水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质.能导电的物质--必须具有能自由移动的带电的微粒,金属能导电--是由于金属中存在能自由移动的带负电的电子.
解答 解:(1)能导电的物质--必须具有能自由移动的带电的微粒,Cu中存在能自由移动的带负电的电子能导电,KNO3溶液中有能自由移动的正负离子,也能导电,故答案为:③⑥;
(2)电解质是在水溶液中或熔融状态下能够导电的化合物,故答案为:①⑤⑧⑨;
(3)强氧化同属于弱碱,醋酸属于弱酸,在水溶液中存在部分电离,属于弱电解质,故答案为:①⑤;
(4)非电解质是在水溶液中或熔融状态下都不能能够导电的化合物,故答案为:②④.
点评 本题要注意电解质和非电解质都是针对化合物而言的,单质、混合物既不是电解质也不是非电解质.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氧为32 g | |
| B. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L | |
| C. | CO2的摩尔质量为44 | |
| D. | 2 mol•L-1的BaCl2溶液中含Cl-的个数为2.408×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐的组成中一定含有金属元素 | |
| B. | 金属一定能与酸反应产生氢气 | |
| C. | 由同种元素组成的纯净物一定是单质 | |
| D. | 同一化合物里同种元素的化合价一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
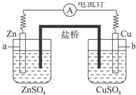
| A. | 有无盐桥不影响该原电池的工作 | |
| B. | 电池工作时,盐桥中K+会向Zn电极一侧移动 | |
| C. | 电池工作时,盐桥中Cl-会向Zn电极一侧移动 | |
| D. | 电池工作时,盐桥中的电子由Cu电极向Zn电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T/℃ | NO初始浓度 ( mol•L-1) | CO初始浓度 ( mol•L-1) | 催化剂的比表面积 ( m2•g-1) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min时容器内气体总的物质的量为3mol | |
| B. | 5min时,容器内D的浓度为0.2mol•L-1 | |
| C. | 该可逆反应随反应的进行,容器内压强逐渐增大 | |
| D. | 在5min内该反应用C的浓度变化表示的反应速率为0.02mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
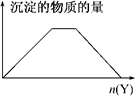
| A. | 向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| B. | 向HCl和AlCl3的混合溶液中滴加溶液 | |
| C. | 向KAl(SO4)2溶液中滴加NaOH溶液 | |
| D. | 向NH4Cl和MgCl2的混合溶液中滴加NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com