
25℃时,水的离子积常数为Kw,该温度下a mol?L-1的HA与bmol?L-1强碱BOH等体积混合,若恰好完全中和,下列结论中不正确的是
A.混合液中:c(H+)≤
B.混合液中:c(HA)+c(A-)=amol?L-1
C.a=b
D.混合液中:c(H+)+c(B+)=c(OH-)+c(A-
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:填空题
图为相互串联的甲、乙两电解池.试回答:
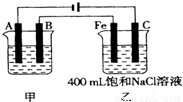
(1)若甲电解池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式 ;B(要求同A)是 ,电极反应式 ;应选用的电解质溶液是 。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 ,C极附近呈 。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是 。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol?L-1,溶液的pH等于 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:实验题
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O,针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①取器连接后,放人固体试剂之前,关闭K,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
② 称取Mg(NO3)2固体3. 79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先______然后固定在管中固体部位下加热。
③ 观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④ 待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应 (填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是 。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列说法正确的是
①向50mLl8mol·L-1的H2SO4溶液中加人足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
②标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4 L
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤在使Al溶解产生H2的溶液中能大量存在:NH4+、Na+、Fe2+、NO3-
A.①②③⑤
B.①③④
C.④
D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
化学来源于生活,并应用于生产生活中。下列关于化学与生产、生活的认识不正确的是
A.将煤气化、液化等方法处理,是提高燃 料燃烧效率的重要措施之一
料燃烧效率的重要措施之一
B.CO2、CxHy、N2等均是造成温室效应的气体
C.乙醇、天然气、液化石油气、氢气都可以作为燃料电池的原料,其中氢气是最为环保的原料
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
2013年CCTV-4报道地球空气温度和30年前相比升高1.5 ℃左右,为控制温室效应,可以将二氧化碳转化为化工原料,如在适当的条件下,二氧化碳和氢气以1︰3的体积比进行反应,可生成某类重要的化工原料和水,则该类化工原料不可能是
A.甲醇(CH3OH)
B.乙烯
C.乙醇
D.甲烷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
混合物除杂是中学化学实验的基础实验,下列除去杂质的方法不正确的是
A 除去氨气中的水蒸气:气体通过装有碱石灰的干燥管
B 除去SO2中少量的SO3气体:气体通过盛浓硫酸的洗气瓶
C 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
D 除去乙醇中少量的乙酸:加足量生石灰,蒸馏
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合2 题型:简答题
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 |
| 0.80 |
n(H2O)/ mol | 0.60 |
| 0.20 |
|
①反应在2 min内的平均速率为v(H2O)=__________;
②800℃时,化学平衡常数K的值为______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。

II.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):

①现象III是 ;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到 mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:
Mg2+(aq) + 2NH3·H2O(aq) 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
下列实验不能达到目的的是
A.用饱和NaHCO3溶液除去CO2中混有的HCl
B.用加热蒸干CuCl2溶液的方法制备无水CuCl2固体
C.用分液漏斗分离CCl4萃取碘水后已分层的有机层和水层
D.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com