
| A. | 煤油与汽油的混合物 | B. | 苯和稀硫酸的混合溶液 | ||
| C. | 四氯化碳和苯 | D. | 乙醇和水的混合溶液 |
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离了 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
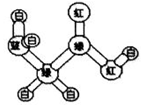 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾与水反应,比钠与水反应更剧烈 | |
| B. | 砹(At)为深色固体,AgAt也难溶于水也不溶于稀硝酸 | |
| C. | 在空气中加热,铷(Rb)的氧化产物比钠的氧化产物更复杂 | |
| D. | HClO的酸性比H2CO3的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气量充足,燃烧充分 | B. | 固体燃料块越大燃烧越充分 | ||
| C. | 液体燃料燃烧时可以雾状喷出 | D. | 温度必须达到着火点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X<Y | |
| B. | 离子半径 X2+<Y- | |
| C. | X与Y的原子序数之差为8 | |
| D. | 在元素周期表中,两者处于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
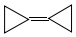 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 是环丙烷的同系物 | ||
| C. | 与环己二烯( 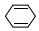 )是同分异构体 )是同分异构体 | D. | 所有的碳原子均在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2为0.2mol/L | B. | Y2为0.2mol/L | C. | Z为0.3mol/L | D. | Z为0.45mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com