
【题目】某混合物A中含有KAl(SO4)2、Al2O3和Fe,在一定条件下可实现如图所示的物质之间的转化:
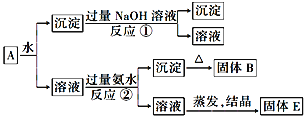
据此判断:
(1)固体B的化学式为________________,其归属的物质类别是:________________。
(2)固体E所含物质的化学式为________________。
(3)写出反应①的化学方程式:_______________________________。
(4)写出反应②的离子方程式:______________________________。
(5)某化学反应产物为Al2O3和Fe,此反应的名称是_________,化学方程式为_____________。
【答案】 Al2O3 两性氧化物 (NH4)2SO4 和K2SO4 Al2O3+2NaOH=2NaAlO2+H2O Al3++3NH3·H2O =Al(OH)3↓+3NH4+ 铝热反应 2Al+Fe2O3![]() 2Fe+Al2O3或者8Al+3Fe3O4
2Fe+Al2O3或者8Al+3Fe3O4![]() 9Fe+4Al2O3
9Fe+4Al2O3
【解析】KAl(SO4)2、Al2O3和Fe混合物溶于水后,得到的沉淀为Al2O3和Fe的混合物,加入过量的NaOH溶液,得到的沉淀为Fe,溶液为NaAlO2;KAl(SO4)2、Al2O3和Fe混合物溶于水后,得到的溶液为KAl(SO4)2溶液,加入过量氨水,Al3+与氨水反应生成Al(OH)3沉淀,Al(OH)3加热分解得到固体B,B为Al2O3,加过量氨水后得到的溶液为(NH4)2SO4 和K2SO4的混合溶液,蒸发结晶得到固体E,E为(NH4)2SO4 和K2SO4的混合物。
(1)根据上面的分析可知B的化学式为Al2O3,Al2O3既能与酸反应又能与碱反应,属于两性氧化物。
(2)根据上面分析可知E为(NH4)2SO4 和K2SO4的混合物。
(3) 反应①是混合物A中的Al2O3与NaOH反应,化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O。
(4) 反应②是混合物A中的Al3+与氨水的反应,离子方程式为:Al3++3NH3·H2O =Al(OH)3↓+3NH4+。
(5) 某化学反应产物为Al2O3和Fe,根据质量守恒可知发生的是Al和Fe2O3(或Fe3O4)之间的铝热反应,对应的化学方程式为:2Al+Fe2O3![]() 2Fe+Al2O3或者8Al+3Fe3O4
2Fe+Al2O3或者8Al+3Fe3O4![]() 9Fe+4Al2O3。
9Fe+4Al2O3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法,不正确的是( ) 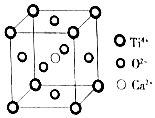
( Ti4+位于顶点上,O2﹣位于面心上,Ca2+位于中心)
A.该晶体的化学式为CaTiO3
B.该晶体中每个Ti4+和8个O2﹣相紧邻
C.一个CO2晶胞中平均含有4个CO2分子
D.金属晶体的熔点可能比分子晶体的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中
D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.
(1)有关上述常数的说法正确的是 .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=
(3)已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为
(4)25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2molL﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1molL﹣1的NaHSO3溶液中c(H2SO3)= .
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究CH3COOH、HA和MOH的酸碱性的相对强弱,某兴趣小组设计了以下实验:室温下,将pH=2的两种酸溶液CH3COOH、HA和pH=12的碱MOH溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图1所示,根据所给数据,请回答下列问题: 
(1)HA为酸 (填“强”或“弱”).稀释后 HA溶液中水电离出来的 c(H+)醋酸溶液中水电离出来c(H+)(填“大于”、“等于”或“小于”).
若b+c=14,则MOH为碱(填“强”或“弱”).
(2)常温下0.10mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变大的是 .
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)c(OH﹣)
D.c(OH﹣)/(H+)
(3)常温下,用0.10molL﹣1 NaOH溶液分别滴定20mL 0.10molL﹣1 HCl溶液和20mL 0.10 molL﹣1 CH3COOH溶液,得到两条滴定曲线,如图所示.如图中滴定醋酸溶液的曲线是(填“图2”或“图3”);曲线上E点pH>8的原因是(用离子方程式表示) .
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中离子浓度由大到小顺序为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计实验验证钠在二氧化碳中燃烧的产物。回答下列问题:
(1)甲组同学利用下列装罝制取干燥纯净的二氧化碳。仪器X的名称是 , 装置B中盛装的试剂是。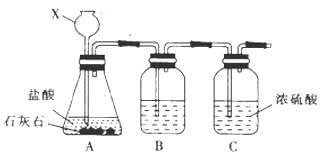
(2)乙组同学利用甲组制得的CO2并选用下列装置(可重复使用)验证钠在二氧化碳中燃烧的产物中是否含有CO。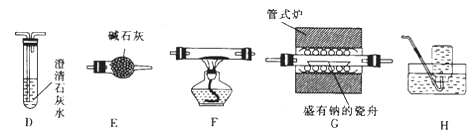
①F中盛装的试剂是。
②装置正确的连接顺序为C→→→→E→→H。
③证明燃烧的产物中含有CO的现象是。
(3)丙组同学取乙组同学在G装置中所得的固体于试管中,加入足量稀盐酸,有气体产生且试管底部有黑色不溶物,则固体产物中一定有(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E五种有机物,它们的分子分别由﹣CH3、﹣OH、﹣COOH、﹣CHO、﹣C6H5( 代表苯基)中的两种组成,这些化合物的性质如下所述: ①A能够发生银镜反应,且相对分子质量为44;
②B溶液加入氯化铁溶液中,溶液显紫色;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应.
请回答下列问题:
(1)B,D的结构简式是:BD
(2)写出A发生银镜反应的化学方程式:
(3)C和E发生酯化反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用右图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
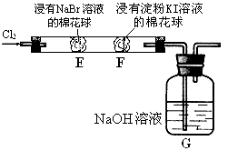
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+ 2Br-=2Cl-+ Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH- + Cl2 = ClO-+ Cl-+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com