
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
分析 A.铝具有较强的还原性,高温下能还原某些还原性较弱的金属;
B.碘离子与氧化剂反应生成单质碘;
C.裂化是一种使烃类分子分裂为几个较小分子的反应过程;
D.铝热反应中铝作失电子作还原剂.
解答 解:A.铝具有较强的还原性,高温下能还原某些还原性较弱的金属,所以铝热反应属于热还原法,故A错误;
B.碘离子与氧化剂反应生成单质碘,则海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O,故B正确;
C.裂化是一种使烃类分子分裂为几个较小分子的反应过程,反应中有新物质生成,属于化学变化,故C错误;
D.铝热反应是高温条件下,Al与金属氧化物反应生成氧化铝和金属单质,所以反应中铝作失电子作还原剂,故D正确.
故选AC.
点评 本题考查氧化还原反应、金属的冶炼方法,把握金属活泼性与常用的冶炼方法、反应中元素的化合价变化为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cu2+、SO42-、OH-、K+ | B. | Fe3+、SCN-、Cl-、H+ | ||
| C. | K+、CO32-、Cl-、H+ | D. | H+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.16 mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CH3COO-)>c (Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.02mol/L | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COO-)+c(H+)=c (Na+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
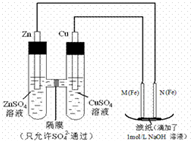 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 坐标对应点 | a | b | c | d |
| n(SO32-):n(HSO32-) | / | 91:9 | 1:1 | 9:91 |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com