
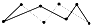 提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=
提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=| 3 |
| 8 |
| 3 |
| 8 |
| 3 |
| 8 |
| b |
| 22.4 |
| b |
| 22.4 |
| 154b |
| 22.4 |
| a |
| 22.4 |
| a |
| 22.4 |
| 154a |
| 44.8 |
| 154b |
| 22.4 |
| 154a |
| 44.8 |


科目:高中化学 来源: 题型:
| A、稀硫酸、氯化钡溶液 |
| B、硫酸亚铁溶液、氢氧化钠溶液 |
| C、氯化钠溶液、硝酸银溶液 |
| D、氯化铝溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应在第2min到第4 min内生成CO2的平均反应速率为前2min的2倍 |
| B、反应开始4min内温度对反应速率的影响比浓度大 |
| C、反应速率先增大后减小 |
| D、反应开始2min内平均反应速率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大容器体积 |
| B、升高温度 |
| C、加入催化剂 |
| D、充入H2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
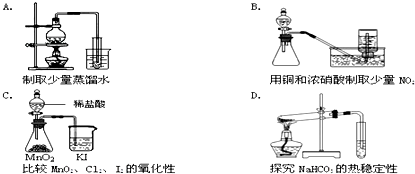
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com