
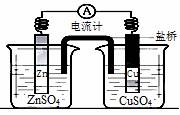
关于右图所示装置的叙述,正确的是:
A.铜是阳极,铜片上有气泡产生
B.盐桥中的阳离子会移向CuSO4溶液
C.正极附近的SO42-离子浓度逐渐增大
D.锌离子在锌片表面被还原
 |
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是 ( )
A. 将过量SO2通入冷氨水中:SO2+NH3·H2O HSO3-+N
HSO3-+N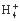
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:N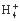 +OH-
+OH- NH3↑+H2O
NH3↑+H2O
C.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O 3I2+6OH-
3I2+6OH-
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3- Ag++NO↑+H2O
Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
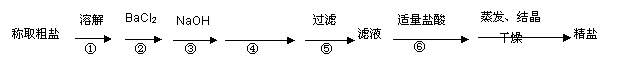 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)步骤②中的BaCl2溶液能否替换成以下溶液:( )
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.A和B均可以 D.A和B均不可以
(2)第④步用到的试剂作用是 ;
(3)利用题干所给试剂,②③④所加试剂的顺序还可以为 (填化学式);
(4)判断BaCl2已过量的方法是 ;
(5)若先用盐酸调溶液至酸性,再过滤,将对实验结果产生影响,其可能的原因是(用相应的化学方程式表示) 。(任意写一个即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A. B.(a+3b)mol C.
B.(a+3b)mol C.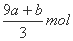 D.(cV-3a-9b)mol
D.(cV-3a-9b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3- 、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是
和 。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解。则:
①X为 (填字母)。
A.Br- B.SO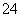 C.CH3COO- D.HCO
C.CH3COO- D.HCO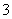
②A中阴、阳离子个数比为
③B的水溶液中所有离子的浓度由大到小的顺序为
(用离子符号表示)。
④将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1 g)。
(3)将Cu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的 (填离子符号),有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是:
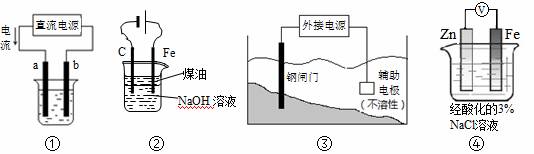
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.用图②装置实验室制备白色Fe(OH)2
C.装置③中钢闸门应与外接电源的正极相连
D.装置④中电子由Zn流向Fe,Zn极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,不正确的是:
A.a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中
c(Na+)>c(CN-),则a一定小于b
B.常温下,CH3COONa溶液的pH=8,则c(Na+) -c(CH3COO-)=9.9×10-7mol/L
C.常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+) =1×10-8,则溶液中由水电离出的
c(H+) =1×10-11mol/L
D.在0.1 mol/L Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是
A.3mol B.4mol C.5mol D.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
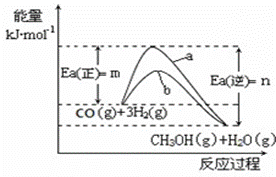 | 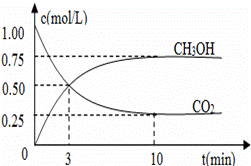 | ||
(1)写出合成甲醇反应的热化学方程式 ;
图1 图2
(2)在图中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线。
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数为__________________,升高温度,K值 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为:_______________________________ 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com