
分析 (1)饱和氯化铁溶液滴入沸水中加热至红褐色为氢氧化铁胶体,胶体吸附正电荷而使胶体粒子带正电;
(2)A.苯与溴水不反应;
B.苯、硝基苯均与水分层,密度不同,乙醇与水互溶;
C.制备乙烯,测定反应液的温度为170℃;
D.水解后检验溴离子,应在酸性溶液中;
E.蒸馏测定馏分的温度;
F.生成少量三溴苯酚溶解在苯中,不能得到沉淀;
H.乙醇能发生催化氧化反应生成乙醛;
G.饱和食盐水反应速率平稳.
解答 解:(1)饱和氯化铁溶液滴入沸水中加热至红褐色为氢氧化铁胶体,反应的离子方程式Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;胶体吸附正电荷而使胶体粒子带正电,则
用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色加深,
故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
(2)A.制备溴苯需要用苯和液溴进行反应,故A错误;
B.乙醇易溶于水,苯和硝基苯均难溶于水,但是苯的密度比水小,在上层,硝基苯密度比水大,在下层,可以用水区分三者,故B正确;
C.实验室制取乙烯时需要将混合液加热至170℃,故需将温度计水银球插入反应液中,故C正确;
D.在加入硝酸银溶液之前应先用稀硝酸中和过量的OH-,避免OH-与Ag+作用生成的沉淀干扰Br-的检验,故D错误;
E.蒸馏时温度计水银球位置应在蒸馏烧瓶支管口处,而不能放在反应液中,故E错误;
F.苯酚可以与浓溴水反应生成白色的三溴苯酚沉淀,不可用稀溴水,故F错误;
G.为乙醇催化氧化反应,操作正确,故G正确;
H.电石与水反应非常剧烈,为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行反应,故H正确,
故答案为:BCGH.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机化学中重要的实验设计或实验操作等,侧重分析与实验能力的综合考查,把握物质的性质、实验技能为解答的关键,注意实验的评价性分析,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 H2SO4 AlCl3 BaCl2 | B. | HCl NaOH K2SO4 NaHCO3 | ||
| C. | AlCl3 KHCO3 NaCl Na2SO4 | D. | NaOH FeCl3 MgCl2 K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有些药物的标签上注明必须冷藏 | |
| B. | 铵态氮肥与草木灰不能同时施用 | |
| C. | 在接触室中加入五氧化二钒使二氧化硫与氧气在其表面反应 | |
| D. | 劈碎的木材燃烧更旺 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
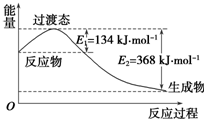 (1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:
(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
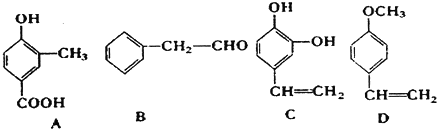
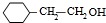 ;1molC最多能与3mol Br2发生反应.
;1molC最多能与3mol Br2发生反应. H
H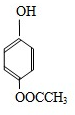 .G和NaOH溶液反应的化学方程式为
.G和NaOH溶液反应的化学方程式为 +2NaOH→
+2NaOH→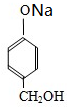 +HCOONa+H2O.
+HCOONa+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com