
 拟用右图装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的是( )
拟用右图装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的是( )| 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl |
| C | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3 |
| D | NH3 | 浓氨水 | NaOH固体 | 浓硫酸 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
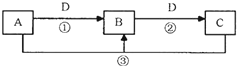 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苹果汁中的Fe2+变成Fe3+ |
| B、苹果汁含有Cu2+ |
| C、苹果汁含有OH- |
| D、苹果汁含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:10:1010:109 |
| B、1:5:5×109:5×106 |
| C、1:20:1010:107 |
| D、1:10:102:107 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠、镁、铁对应的氧化物都是碱性氧化物 |
| B、食醋、纯碱、食盐分别属于酸、碱、盐 |
| C、生铁、不锈钢、青铜都属于合金 |
| D、明矾、小苏打、水玻璃、次氯酸均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| E | F |
| 物质 | X | Y | Z | W |
| 起始投料/mol | 2 | 1 | 2 | 0 |
| 实验序号 | ① | ② | ③ |
| 压强p/Pa | 1×105 | 2×105 | 1×106 |
| c(Y)/mol?L-1 | 0.08 | 0.12 | 0.68 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com