
| A、①②③ | B、③②① |
| C、②①③ | D、②③① |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ①O3 |
| ②Zn/HCl |
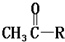
| I2/NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
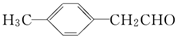 )转化为对甲基苯乙炔(
)转化为对甲基苯乙炔(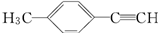 )的一条合成路线如下:
)的一条合成路线如下: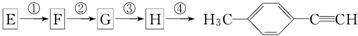 (G为相对分子质量为118的烃).
(G为相对分子质量为118的烃).| 序号 | 所加试剂及反应条件 | 反应类型 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
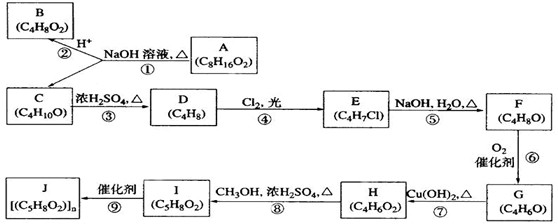
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x由三种元素组成 |
| B、x只有还原性 |
| C、x中含碳40% |
| D、x的分子中有甲基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的pH小于7 |
| B、c(CH3COOH)+c(CH3COO-)=0.20mol?L-1 |
| C、c(CH3COOH)<c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=0.10mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/(min) | n(A)/( mol) | n(B)/( mol) | n(C)/( mol) |
| 0 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
| 第8min | 0.1 | 2.0 | 1.8 |
| 第9min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积 |
| B、相同温度下,0.2mol?L-1醋酸溶液和0.1mol?L-1醋酸溶液中的c(H+) |
| C、在0.1mol?L-1NaHSO4溶液中,阳离子数与阴离子数 |
| D、在FeCl2溶液中,c(Cl-)与c(Fe2+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com